Получение порошков методом самораспространяющегося высокотемпературного синтеза. Метод печного синтеза металлоподобных соединений не позволяет удовлетворить современные требования прикладного материаловедения по чистоте получаемого продукта и производительности. Поэтому активно развиваются другие методы получения таких порошков, среди которых отметим синтез в низкотемпературной плазме, ударно-волновое сжатие и самораспространяющийся высокотемпературный синтез (СВС), имеющий в настоящее время наибольшее значение.
В основе СВС лежит явление распространения фронта горения в порошках некоторых тугоплавких химических элементов, приводящее к образованию соответствующих соединений. Метод СВС основан на использовании сильной экзотермичности взаимодействия большинства элементов с бором, углеродом, азотом, кремнием и другими металлоидами, связанной с большой теплотой образования продукта, и высоких значений энергии активации диффузии атомов металлоидов в металлах. Эти особенности процесса позволяют реализовать возможность протекания реакции взаимодействия в узкой зоне, перемещающейся по веществу за счет теплопередачи после локального (местного) инициирования реакции в ненагретой смеси компонентов.
|
|
|
В зависимости от химической природы ведущей реакции горения и агрегатного состояния реагентов все СВС-системы можно разделить на четыре основных класса: безгазовые (без образования газообразных продуктов сгорания), фильтрационные, газовыделяющие, металлотермического типа (с восстановительной стадией). В безгазовых системах (возможно небольшое газовыделение, связанное с самоочисткой от примесей) исходные компоненты, промежуточные и конечные продукты находятся в конденсированном (твердом или расплавленном) состоянии. Синтез можно проводить в вакууме или в инертном газе (состав продуктов горения и его параметры слабо зависят от атмосферы процесса). В фильтрационных системах синтез идет в гибридных системах металл–газ и состав продуктов горения, а также его параметры сильно зависят от давления и состава газовой среды. Большое значение имеют габариты и пористость сбрикетированного металлического порошка, определяющие доставку (фильтрацию) газа в зону реагирования (горения) компонентов, которая может быть организована различным образом. На практике чаще применяют схему, при которой образец с полностью открытой поверхностью помещен в среду газообразного окислителя и фильтрация осуществляется как через исходную шихту, так и через продукты горения.
Газвыделяющими являются системы с легколетучими компонентами (S, P, Se и др.) и сжиженным газом (жидким азотом). Целесообразно вести синтез в герметичных емкостях, полностью заполненных твердыми компонентами, так как при их испарении они не покидают реакционный объем, а заполняют лишь поровое пространство.
|
|
|
В системах металлотермического типа горение имеет две принципиально различные химические стадии – восстановление оксидов и последующее взаимодействие образовавшихся элементов между собой и с добавками, вводимыми в шихту. Такие СВС-процессы могут быть магний- или алюмотермическими. Должна быть предусмотрена возможность отделения целевого продукта от оксидов восстановителя (MgO или А12О3).
В общем случае распространение волны горения является одним из возможных режимов, в котором могут протекать экзотермические реакции; при этом исходная смесь реагентов отделена сравнительно узкой зоной горения от продуктов реакции. Начальная температура шихты низкая (например, комнатная), а температура в зоне реакции, называемая температурой горения, может достигать 3 000–4 000 К.
В стационарных условиях зона горения перемещается в сторону исходной шихты с чрезвычайно высокой постоянной скоростью (до 105–106 К/с), называемой нормальной скоростью горения.
На рис. 16 представлена схема СВС-технологии получения порошков, синтез которых проводят в реакторе (рис. 17) с различным объемом реакционной зоны.
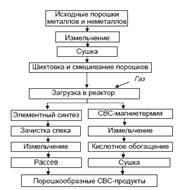
Рис. 16. Схема СВС-технологии получения порошков
Внутреннее устройство реактора зависит от вида синтезируемых СВСпродуктов. При синтезе карбидов, боридов или силицидов внутреннюю поверхность реактора футеруют графитом.
Для синтеза нитридов, карбонитридов и гидридов реактор оснащают специальным устройством, обеспечивающим фильтрацию реагирующего газа в зону реакции; для синтеза халькогенидов, фосфидов и металлотермических процессов устройство реактора позволяет исключить испарение компонентов шихты и их конденсацию на его внутренней поверхности.
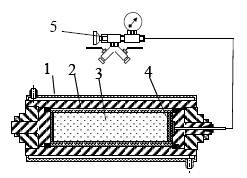
Рис. 17. Схема СВС-реактора: 1 – корпус; 2 – графитовая футеровка; 3 – реакционная
шихта; 4 – грибковый затвор; 5 – газораспределительный узел
После загрузки шихты, которая может быть предварительно сбрикетирована, реактор закрывают и в зависимости от целевой задачи вакуумируют или заполняют газом (инертным либо участвующим в реакции). Локальное инициирование начала процесса СВС осуществляют с пульта управления подачей кратковременного электрического импульса на вольфрамовую спираль, касающуюся исходной шихты.
Процесс синтеза сопровождается ярким свечением, так как температуры горения в зависимости от конкретной системы составляют 1500–4000 °С. Светящаяся зона распространяется либо плавно, либо пульсирует; скорость ее движения составляет обычно 0,5–15,0 см/с. После прохождения фронта горения образец продолжает светиться в течение времени, превышающего длительность охлаждения; это связано с наличием двух макрокинетических стадий протекания химической реакции – в узкой зоне в процессе распространения фронта горения и во всем объеме шихты (брикета).
Получаемые соединения однофазны, хорошо кристаллизованы, хотя иногда получаются и аморфные порошки. Чистота синтезируемых соединений не ниже чистоты исходных реагентов, так как дополнительного загрязнения в процессе СВС не происходит.
Взрывной механохимический синтез (ВМС). Механический метод активации (МА) твердофазных химических реакций позволяет проводить их в режиме теплового взрыва. В этом случае роль механической активации заключается в инициировании экзотермической реакции, которая в дальнейшем протекает за счет выделения тепла химической реакции. С использованием ВМС получают сульфиды, карбиды, карбонитриды, силициды и другие тугоплавкие соединения.
|
|
|
Исходные компоненты (стружка, спеки или кусковой материал) подвергают высокоэнергетической механоактивации в герметичном механореакторе энергонапряженной мельницы. Передача энергии происходит за время от нескольких до десятков минут. Тем самым в процессе ВМС осуществляется постепенная «накачка» избыточной энергией реагирующих компонентов. При достижении критических значений этой энергии начинается реакция, протекающая по взрывной кинетике.
Механохимический синтез тугоплавких соединений осуществляется различными методами. Наиболее простой из них – прямой синтез, когда реакция протекает между двумя или несколькими элементами. Более сложный синтез представляет собой сочетание реакций восстановления и синтеза. Этот способ позволяет использовать дешевое сырье (оксиды), а также получать различные соединения металлов.
Золь-гель процесс в технологии получения порошков. В основе этого процесса лежит образование гидроксидов металлов в результате химического превращения высокодисперсных систем (золей) в рыхлые аморфные структуры (гели).
Золи представляют собой системы, в которых частицы высокодисперсной твердой фазы свободно участвуют в броуновском движении, стабилизирующем их во взвешенном состоянии. Различают гидрозоли, органозоли и аэрозоли, у которых дисперсионная среда, соответственно, вода, органическая жидкость или газ. Золи способны коагулировать, т.е. образовывать крупные агрегаты частиц в виде структурированных систем с последующим разделением фаз – разрушением дисперсной системы. При коагуляции золи превращаются в гели – структурированные системы, в которых частицы соединены в рыхлую пространственную сетку. Коагуляция происходит при удалении лишней воды из системы, вызванном повышением или понижением температуры, воздействием электромагнитных полей, жестких излучений, механическими или химическими воздействиями.
Процессы в водных средах основаны на превращениях, происходящих в такой последовательности: гидролиз → полимеризация → нуклеация → рост.
|
|
|
Результатом гидролиза является связывание некоторых молекулярных групп, содержащих ионы кислорода, с катионами (металлами); в процессе полимеризации происходит образование мостиковых связей между двумя или более катионами посредством лигандов.
Золь-гель процессы можно разделить на коллоидные и полимеризационные. Гелеобразование в коллоидных системах происходит в растворах, содержащих золь одного или более компонентов. Полимеризационный процесс включает процессы поликонденсации с формированием непрерывной полимерной структуры геля, который может содержать катионы различной природы. Полимеризационные процессы происходят с исходными компонентами, которые ионизируются или не ионизируются в растворителе. При использовании ионизируемых исходных компонентов (солей металлов) катионы металла Me в результате взаимодействия с дипольными молекулами воды образуют группы типа Ме(Н2О)n Z+, которые выделяют протон, сохраняя свое координационное состояние. При взаимодействии образующихся положительно заряженных групп с соответствующими анионами образуются группы, катионы которых могут быть связаны лигандами, включающими О2- (кислородные мостики), ОН- (гидроксильные мостики), Н2О (водные мостики), и анионами А-. Процесс полимеризации зависит от рН среды, температуры (образование комплексов часто ускоряется с повышением температуры), концентрации катионов металлов и природы анионов.
Типичным процессом с неионизируемым исходным компонентом является алкоксидный золь-гель процесс. После гидролиза алкоксида проводят поликонденсацию с дегидратацией: 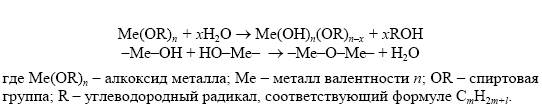
В результате формируются полимерные макромолекулы (гели) с открытой монолитной структурой. Размер и распределение частиц порошка зависят от скорости образования статистических зародышей критического размера (нуклеации) и последующего их роста. Для достижения монодисперсности порошков необходимо регулировать или концентрацию исходных компонентов и растворителя (на стадии нуклеации), или извлечение анионов (катионов) из раствора.
Золь-гель методом изготавливают порошки BaTiO3, ZrO2, TiO2, WO3, SrTiO3, Y2O3, A12O3, SiO2, 2Al2O3-2SiO2, Si3N4 и другие, оксидные микросферы диаметром от 10 до 2 000 мкм и волокна. Получаемые этим методом порошки активны при спекании. Кроме того, золь-гель метод позволяет получать новые классы материалов, в том числе композиционные, содержащие в матрице дисперсные металлические частицы.
 2014-02-02
2014-02-02 3534
3534
