Миокард по своей структуре более гетерогенен, чем скелетная мускулатура. Кроме клеток рабочего миокарда, которые относятся к поперечно-полосатой мускулатуре, имеются проводящая система, состоящая из атипичных Т-клеток. Их отличает наличие отростков, кластерная форма, отсутствие вставочных дисков и саркомера.
Структурно-функциональной единицей клеток рабочего миокарда является кардиомиоцит–одноядерная клетка цилиндрической формы, длиной 10–100 мкм, диаметром 7-50 мкМ. Покрыт кардиомиоцит, как и скелетное волокно, двухслойной мембраной – сарколеммой. Саркомер кардиомиоцита несколько короче, чем у скелетной мышцы (1,5-1,7мкм)
Особенности:
1. Наличие вставочных дисков, на которых обрывается саркомер, общих для нескольких кардиомиоцитов.
2. Т-система контактирует только с продольными трубочками СПР, образуя диаду.
Потенциал покоя (ПП) кардиомиоцитов
Распределение концентаций (в мМ) ионов снаружи (ех) и внутри (in) кардиомиоцита при потенциале покоя (ПП) представлена в таблице ниже:
| Na+ | Cl- | K+ | Ca2+ | |
| ex | ||||
| in | 10-7м/л |
Равновесные электро-химические потенциалы, участвующие в образовании ПП кардиомиоцитов равны для ионов:
Калия Ем – Ек = -80- (-100) = 20мВ,
Натрия Ем – ЕNa = -80 – (+50) = -130мВ
Хлора Ем – ЕCl = -80 – (+80) = 0мВ – пассивное распределение
Кальция Ем – ЕCa = 2[-80 – (+45)] = 450мВ
Транспортные системы, которые поддерживают ПП на уровне –80 / –90 мВ:
1. Nа+/K+ –АТФаза, удаляющая из клеток 3 иона натрия в обмен на 2 иона калия -электрогенна и уменьшает Ем.
2. Са2+ – АТФаза поддерживает очень высокий градиент для ионов кальция, удаляя их наружу.
3. Nа+/Са2+ – обмен выносит ионы кальция, используя градиент к ионам натрия. При деполяризации мембраны – работает в обратном режиме, оставляя ионы кальция внутри.
Потенциал действия (ПД) рабочего миокарда имеет сложную структуру (Рис.):
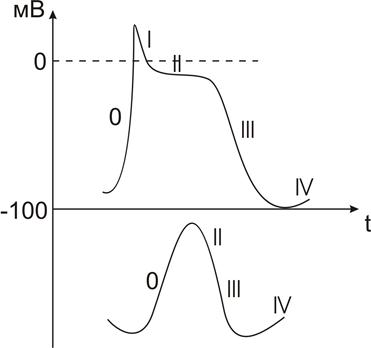 |
1. Фаза быстрой регенеративной деполяризации
2. Фаза быстрой регенеративной реполяризации
3. Фаза медленной реполяризации
4. Конечная реполяризация
5. Межимпульсный потенциал.
Фаза быстрой регенеративной деполяризации (О-фаза) обеспечивается входящим ионным током (Iвх), который линейно зависит от Naext, и чувствителен к действию блокатора натриевых каналов ТТХ.
Вывод: входящий ток натриевой природы: INa = (t = 1-2 мсек, амплитуда = 1мкА/см2) связан с открыванием быстрых потенциал-зависимых натриевых каналов.
Фаза быстрой регенеративной реполяризации и медленной реполяризации
Представляют совокупность:

Один из компонент входящего ионного тока – медленный входящий ток IIi (порог – 35-10мВ max при 0мВ; t» 10-20мс.) не чувствителен к блокатору натриевых каналов ТТХ и не зависит от Naеxt. Зато он чувствителен к внеклеточному кальцию и действию блокаторов кальциевых каналов.
Вывод: Совместно с ионами натрия за генерацию ПД кардиомиоцитов отвечают ионы кальция.
Особенности IIi: зависимость от метаболизма цАМФ, ионов кальция и рН.
Фосфорилирование канала приводит к увеличению его времени жизни и количеству активированных представителей. Мишенью для фосфорилирования является a-субъединица (150кД) кальциевого канала- кальцидуктин. Фермент, отвечающий за фосфорилирование - каталитическая субъединица (29кД) цАМФ-зависимой протеинкиназы.
Кальций-зависимая регуляция кальциевых каналов осуществляется с помощью кальций-связывающего белка кальмодулина (СаМ), распологающегося в их устье.
РН-зависимая регуляция кальциевых каналов: связана с тем, что при РНe ниже 7,0 снижается кальциевый ток, а при рНе = 6,1 он вообще равен 0.
Фазы реполяризации ПД кардиомиоцитов обусловлены:
1. Инактивацией натриевых каналов;
2. Активация выходящиего ионного тока – Iвых.
Природа Iвых транзиторный калиевый ток ( ,t – 50 мсек). Он чувствителен к блокаторам калиевых каналов: ТЭА, 4-аминопиридину, ионам цезия.
,t – 50 мсек). Он чувствителен к блокаторам калиевых каналов: ТЭА, 4-аминопиридину, ионам цезия.
Подразделяют транзиторный ток в зависимости от механизмов регуляции на:
 Са-зависимый
Са-зависимый

 -ток
-ток
Са-независимый
 Потенциал-чувствительные
Потенциал-чувствительные
 а К+-каналы
а К+-каналы
Кальций-чувствительные
Калиевые каналы, через который идет калиевый ток в зависимости от порога (jакт.) и времени активации (t) разделяют на:
| jакт. | t | |
| К+t0- | -50мВ | 50мсек |
| аномального выпрямления | ПП | 0-20мсек |
| задержанного выпрямления | –90-50мВ | Ix1 Ix2 |
| 500мсек; 5сек |
Фаза плато (Фаза 2) ПД кардиомиоцитов обусловлена тем, что в этот период изменение мембранного потенциала не происходит:
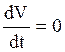 , тогда общий ионный ток равен нулю (I=0), за счет того, что выходящая компонента становится равной выходящей:
, тогда общий ионный ток равен нулю (I=0), за счет того, что выходящая компонента становится равной выходящей:
Iвх= Iвых
Iвх обусловлена Isi, тогда как,
Iвых = Iк + Il
Фаза плато сменяется вновь реполяризацией (3), которая обеспечивается продолжающейся активацией Iк и наступлением инактивации Isi.
Нобл (1962) предполагал, что Iвых обеспечивают К+-каналы аномального выпрямления, так как при Е< -60мВ они открыты, но закрываются при деполяризации, что снижает Iвых. Ходоров такие каналы нашёл в нейроне (Iк2).
Фаза конечной реполяризаци (Фаза 3) ПД кардиомиоцитов о беспечивается нарастанием процесса инактивации Isi, и активации Iк. В результате I0-выходящий становится больше входящего. По природе Iк1 протекает по каналам задержанного выпрямления (Ix1 -t = 500мсек; Ix2 – t =5сек).
Электромеханическое сопряжение в миокарде отличается от скелетного волокна тем, что в регуляции сокращения, наряду с кальцием СПР, в нем участвует внеклеточный кальций. Подтверждает эту точку зрения то, что Isii соотносится с силой сокращения на разных уровнях мембранного потенциала:
1. –60-50мВ–активация сокращения пороговый уровень Isii и сокращения не совпадают,
2. –20-+20мВ – пик Isii и сокращение тесно коррелируют,
3. > 20мВ величина Isii снижается более круто, чем сила сокращения.
Транзиторное изменение концентрации ионов кальция в цитоплазме обеспечивает:
1. Передачу возбуждения с сарколеммы на сократительный аппарат.
2. Насыщение ионами кальция приводит к генерации максимального сокращения.
3. Удаление ионов кальция из цитоплазмы – фактор расслабления.
Зависимость силы сокращения от частоты стимуляции говорит о том, что чем больше частота стимуляции, тем меньше пауза между двумя стимулами, меньше период покоя и ионы кальция не успевают закачиваться в СПР и выходить из клетки. Накопление ионов кальция в СПР приводит к повышению сокращения в последнем стимуле. Таким образом, Isi непосредственно не обеспечивает сокращение, а лишь стимулирует высвобождение ионов кальция из СПР. Isi подпитывает СПР ионами кальция (быстрая фаза Isii -ПД, медленная – подпитка).
Данная точка зрения подтвердилась в экспериментах Изенберга (одиночный кардиомиоцит + фиксация напряжения + регистрация сокращения + определение внутриклеточного кальция.)
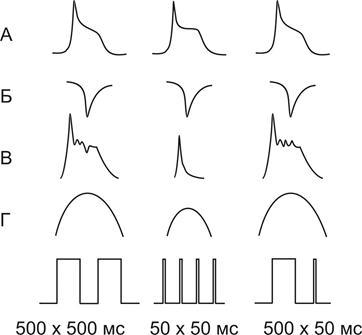 |
1. При чередовании импульсов 500 мс чрез 500 мс регистрировался ПД, Isi, Z1 и Z2 – быстрая и медленная компонента увеличения внутриклеточного кальция и сокращение.
2. При сокращении длительности импульсов до 50 мс ПД развивался, но Z2 и Isi – укорачивались, амплитуда сокращение снижалась.
3. Если первый стимул был короткий 50 мс, а второй нормальный -500 мс, то отсутствовала фаза Z2, величина Isi была нормальной, амплитуда сокращения снижалась.
4. Если первый стимул был нормальный 500 мс, а второй короткий 50 мс, то на фоне ПД были выражены обе фазы Z1 и Z2, и, хотя Isi укорачивался, амплитуда сокращения была как в контрольном случае.
Вывод:
1. Фаза Z1 совпадает с Isi и им обусловлена.
2. Фаза Z2 – связана с выбросом кальция из СПР и определяет амплитуду сокращения.
Автоматию сердца обеспечивают Р-клетки (N-клетки) – пейсмекеры, которые подразделяют на истинные и латентные. Они располагаются в синатриальном узле, атриовентрикулярном узле, пучках Бахмана, Гисса
Р-клетки объединены в пучки (гроздья) с общей базальной мембраной и у каждой своя плазматическая мембрана. Структура синатриального узла сочетает в центральной части Р-клетки; ближе к периферии – промежуточные клетки и рабочий миокард.
Электрофизиологические параметры Р-клеток.(Рис.)
1. плавный переход межимпульсного периода в фазу О ПД;
2. нет периода стабилизации фазы 4, т.е. нет как такового ПП. Существует медленная диастолическая деполяризация (МДД - max –50-60мВ);
3. медленная  в фазу 0 (~ 10 в/с);
в фазу 0 (~ 10 в/с);
4. закругленная вершина;
5. отсутствие плато;
6. отсутствие или низкий овершут;
7. ПД не чувствителен к ТТХ, но угнетается блокаторами кальциевых каналов
8. Латентные пейсмекеры имеют большую скорость dV/dt в фазу 0 и меньшую скорость МДД, имеют плато с горбом.
Механизмы автоматии основаны на том, что состоянии покоя сумма входящих и выходящих ионных токов равна: S Iвх = S Iвых
Для возникновения МДД необходимо, чтобы S Iвх > S Iвых достаточного для достижения уровня порога и возникновения ПД.
Согласно гипотезе Бабского смещение INc в сторону более отрицательного ЕМ, например, до -70мВ, при ПП в –55-60мВ будет приводить к усилению Iвх.
Согласно гипотезе Ходорова этого же эффекта можно достичь при снижении выходящего калтевого тока K.
Согласно гипотезе Noble, Tsien (1980) в этом процессе задействованы Iк2 – каналы аномального выпрямления, которые кратковременно активируются при гиперполяризации мембраны, а затем их инактивация может привести к развитию МДД.
Хроноинотропия – сила сокращения зависит от частоты стимуляции.
Если она возрастает – это лестница Боудича, если снижается – Вудвордса.
Оценка хроноинотропии проводится сравнением амплитуд тестируемого сокращения (Ах) к фоновому (Аф):


Если Р > 0 - лестница Боудича; Если Р <0 – Вудвордса.
Гипотеза Кохвезера: при возбуждении мышцы выделяются 2 фактора, которые действуют на сократительный аппарат:
1. NIEA – негативный инотропный эффект активации – вызывает снижение сокращения.
2. PIEA – позитивный инотропный эффект активации – усиливает сокращения.
В текущем режиме величина тестирующего сокращенияравна:
Ат =Аф + PIEA – NIEA.
Если Ат > Аф - лестница Боудича; если Ат <Аф – Вудвордса.
Предположительные (гипотетические) факторы, влияющие на хроноионотропию:
1. Параметры ПД (увеличивается амплитуда и длительность ПД) -не соответствует экспериментальным данным, так как все наоборот.
2. Влияние нейрогуморальных факторов, но изопротеринол, резерпин (истощение кальциевого депо катехоламинами), атропин – все не действуют на хроноинотропию.
3. Турпаев предположил участи метаболитов хроноионотропном эффекте.
4. Участие ионов калия, которые ингибируют образование акто-миозинового комплекса. При частой стимуляции теряется Кint, за счёт активации Nа+/К+-АТФ-азы и увеличивается амплитуда сокращения. Но после эстрасистолы – эффект облегчения, хотя [К]int – та же.
5. Чем больше ионов кальция, тем больше амплитуда сокращения. Кальций может поступать либо извне, либо из депо. Предпочтительней второй путь. Чем меньше потеря кальция в среду, тем больше его выйдет из СПР при втором стимуле и усилит второе сокращение.
6.Изаков отмечает роль Nа+/К+-АТФазы. При ПД входит много Nа+, который скапливается в примембранных слоях и активирует Nа/К-АТФазу. Это тормозит Iвых. К и наступает поздняя реполяризация, которая увеличивает поступление кальция в клетку и сокращение.
7. Nа+/Са2+-обмен. При увеличении Nаi за счёт ПД создаётся локальный grad Nai ® Nae и усливает работу Nа+/Са2+ -обмена в обратном режиме, что увеличивает поступление кальция в клетку и сокращение.
Особенности биомеханики миокарда заключается в том, что онне способен к тетанусу и обладает большим напряжением покоя. Сокращение зависит от длины мышцы и частоты стимуляции. Скорость сокращения сердечной мышцы; меньше, чем скелетной мышцы.
В миокарде резко выражена зависимость силы сокращения от длины мышцы – Закон Франка-Старлинга (Энергия, выделяемая мышцей при переходе от покоя к сокращению, пропорциональна площади исходной активной поверхности) и, чтобы построить кривую «сила-длительность», надо делать опыты при данной мгновенной длине мышцы.
 2014-02-03
2014-02-03 2488
2488
