Выщелачиванием называют процесс перевода в раствор ценных составляющих руды или концентрата.
В дальнейшем водный раствор отделяется от твердого остатка (шлама, кека, хвостов) фильтрацией, или декантацией (слив осветленной жидкости после осаждения шлама) и направляется на дальнейшую переработку.
Если в результате выщелачивания получается насыщенный раствор, то имеет место динамическое равновесие между твердым веществом и его ионами в растворе:
КAтв. = К+ + А-
тогда математическое выражение закона действующих масс будет таково:
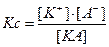
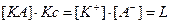 - произведение растворимости электролита при данной температуре (величина постоянная при данной температуре вне зависимости от соотношения этих ионов в насыщенном растворе).
- произведение растворимости электролита при данной температуре (величина постоянная при данной температуре вне зависимости от соотношения этих ионов в насыщенном растворе).
Произведение растворимости может быть определено, как максимальное произведение концентраций ионов электролита, существующих при определенной температуре в равновесии с нерастворенной фазой.
Основными факторами, влияющими на процесс выщелачивания, являются следующие:
|
|
|
1. Величина поверхности растворяющегося вещества. Так как растворение происходит на поверхности раздела растворимого вещества и растворителя, то процесс будет протекать тем быстрее и полнее, чем больше будет величина активной поверхности растворяющегося вещества.
2. Скорость диффузии ионов в растворе. Так как в результате взаимодействия между растворителем и растворяющимся компонентом вокруг поверхности твердого вещества образуется слой насыщенного раствора, то этот насыщенный раствор должен быть удален с поверхности или должен продиффундировать в остальную массу раствора, после чего растворение твердого вещества будет продолжаться.
3. Температура. Реакция выщелачивания ускоряется с повышением температуры
4. Концентрация растворителя. Наилучшей концентрацией растворителя следует считать такую, при которой достаточно быстро растворяется ценный компонент и переходит в раствор минимальное количество примесей.
Кинетические особенности процесса выщелачивания
Скорость растворения твердого вещества:
- прямо пропорциональна поверхности контакта твердой и жидкой фаз (Sпов.);
- определяется разностью концентрации — предельной (концентрации насыщенного раствора - снас.) и существующей в данный момент в растворе (сраств.):
v = k Sпов.(снас. - сраств.)
При cpаств. = 0скорость растворения будет максимальной, ибо твердое вещество будет растворяться в чистом растворителе; при cpаств. = cнас. скорость растворения будет равна нулю, так как твердое вещество будет находиться в насыщенном растворе.
Если D - коэффициент диффузии, а δ – толщина диффузионного слоя, то вышеприведенное уравнение трансформируется в так называемое уравнение Нернста (уравнение скорости гетерогенного процесса), которое в общем случае выглядит следующим образом:
|
|
|
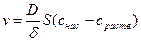
Если в этом выражении v есть приращение растворенного вещества за единицу времени, а при постоянной температуре D, S и δ величины, постоянные, и обозначив 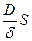 через постоянную величину К (константа скорости растворения), получим следующее выражение для приращения концентрации растворенного вещества за единицу времени:
через постоянную величину К (константа скорости растворения), получим следующее выражение для приращения концентрации растворенного вещества за единицу времени:
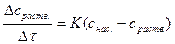
После дифференцирования и интегрирования можно определить приращение концентрации растворенного вещества в момент τ 2, зная концентрацию в момент τ 1:
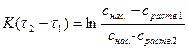
Практические мероприятия по увеличению скорости выщелачивания основываются на изменении величин, входящих в уравнение Нернста:
- увеличение величины поверхности контакта между твердой и жидкой фазами;
- увеличение температуры, что приводит к росту коэффициента диффузии - D, изменение с н, изменение толщины диффузионного слоя - δ;
- увеличение интенсивности перемешивания, что позволяет регулировать интенсивность подвода реагентов и отвода продуктов реакции и к изменению толщины диффузионного слоя - δ.
Получение водных растворов соединений металла является промежуточной стадией в общей цепи процессов, приводящих к получению металла. Последующей стадией является выделение металла из его соединения.
Осаждение металлов (соединений металлов) из раствора
Металлы (соединения металлов)из растворов можно осаждать различными способами. Наиболее распространенными являются:
1) кристаллизация;
2) цементация;
3) электролиз.
1. Кристаллизация
Кристаллизация является наиболее давно известным и самым простым способом осаждения соединений металлов из растворов.
Возможность осаждения того или иного растворенного вещества из раствора может быть определена из диаграмм растворимости водно-солевых систем. Большинство из промышленно значимых диаграмм растворимости приведены в справочной литературе.
Осаждение можно провести тремя путями:
1) изменением концентрации раствора, например, путем удаления растворителя выпариванием, до тех пор, пока раствор не сделается пересыщенным и в нем не начнется кристаллизация;
2Na+ + mK+ + nCO32- + aq = Na2CO3↓ + mK+ + (n-1)CO32- + H2O↑
2) понижением температуры раствора с целью понизить растворимость соединения металла в растворе и тем самым вызвать пересыщение и кристаллизацию;
mK+ + nCO32- + aq = K2CO3↓ + (n-1)CO32- + (m-2)K+
3) добавлением вещества, ионы которого способны образовывать в данной системе нерастворимые соединения.
2K+ + Na2SO4 = K2SO4↓ + 2Na+
В технике чаще всего производят кристаллизацию путем сочетания выпаривания с последующим понижением температуры.
Как правило, производственные растворы представляют собой сложные системы, состоящие из нескольких растворенных веществ. Чтобы получить достаточно чистые по содержанию примесей осадки из такого раствора, необходимо подобрать условия, при которых из большой группы веществ, содержащихся в растворе, кристаллизовалось бы только одно, а остальные оставались в растворе.
Одним из приемов позволяющих выделять в твердую фазу требуемые вещества является дробная кристаллизация.
Процесс дробной кристаллизации основан на растворимости различных веществ при различных температурах. Если данное вещество должно выделиться из раствора в возможно чистом состоянии, концентрация раствора и температура кристаллизации должны регулироваться так, чтобы некоторое количество вещества осталось в растворе. Часто бывает необходимо полученные кристаллы вновь растворять и производить рекристаллизацию.
Факторы, влияющие на скорость процесса кристаллизации, такие же, как и при растворении твердого вещества. Количество выкристаллизовавшегося вещества в единицу времени будет определяться формулой, подобной выражению для выщелачивания:
|
|
|
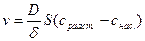
где S – величина поверхности твердой фазы;
снас. – концентрация насыщенного раствора;
сраств. – концентрация в растворе.
2. Цементация.
Цементацией называется процесс вытеснения металлов из растворов другим металлом – цементатором, окислительно-восстановительный потенциал которого более электроотрицателен.
Располагая металлы согласно ряду напряжений (табл.), можно сказать, какие металлы способны вытеснять данный металл из раствора его соли.
| Катион металла | Стандартный электродный потенциал, В |
| Na+ + e = Na | -2,713 |
| Al3+ + 3e = Zn | -1,662 |
| Zn2+ + 2e = Zn | -0,763 |
| Fe2+ + 2e = Fe | -0,440 |
| H+ + e = H | |
| Cu2+ + 2e = Cu | 0,337 |
| Au+ + e = Au | 1,692 |
Для цементации меди (из сульфатного раствора Cu2+, SO42-) обычно применяется железо (железный скрап), для цементации золота - цинк:
Fe + CuSO4 = FeSO4 + Сu;
2КАu(CN)2 + Zn = K2Zn(CN)4 + 2Au;
Zn + CuSO4 = ZnSO4 + Сu.
При погружении металла-цементатора в раствор, содержащий ионы вытесняемого металла, на поверхности катода выделяется металл. Одновременно на металле-цементаторе протекают обратные процессы – ионизация атомов вытесняющего металла (анодные участки).
Zn0 → Zn2+ + 2e
Cu2+ + 2e = Cu0
По мере выделения металла изменяется его концентрация, а следовательно, и значение потенциала, поскольку потенциал связан с концентрацией соотношением:
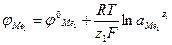
где φ0Me1 - стандартный электродный потенциал, В;
z1 – валентность иона металла;
F – число Фарадея (96500 кулонов);
а1 – активность иона металла в растворе.
Процесс цементации будет протекать до установления равновесия, когда φ0Me1 = φ0Me2.
 2014-02-09
2014-02-09 4490
4490
