АМОРФНЫЕ ТВЕРДЫЕ ТЕЛА.
ТВЕРДЫЕ ТЕЛА.
Твердое тело – агрегатное состояние вещества, для которого характерно наличие значительных сил межмолекулярного взаимодействия, стабильность формы и объема. Тепловое движение частиц твердого тела представляет собой небольшие по амплитуде колебания около положений равновесия. Различают кристаллическое и аморфное строение твердых тел.
Аморфные твердые тела по многим своим свойствам и главным образом по микроструктуре следует рассматривать как сильно переохлажденные жидкости с очень высоким коэффициентом вязкости. Структура таких тел характеризуется только ближним порядком в расположении частиц. Некоторые из таких веществ вообще не способны кристаллизоваться: воск, сургуч, смолы. Другие при определённом режиме охлаждения образуют кристаллические структуры, но в случае быстрого охлаждения рост вязкость препятствует упорядочению в расположении частиц. Вещество затвердевает раньше, чем реализуется процесс кристаллизации. Такие тела называются стеклообразными: стекло, лёд. Процесс кристаллизации в таком веществе может произойти и после затвердевания (помутнение стёкол). К аморфным относят и твёрдые органические вещества: резина, дерево, кожа, пластмассы, шерстяные, хлопковые и шёлковые волокна. Процесс перехода таких веществ из жидкой фазы в твёрдую представлен на рис. – кривая I.
|
|
|
Аморфные тела не имеют температуры затвердевания (плавления). На графике Т = f(t) имеется точка перегиба, которую называют температурой размягчения. Снижение температуры приводит к постепенному росту вязкости. Такой характер перехода в твёрдое состояние, обуславливает отсутствие у аморфных веществ удельной теплоты плавления. Обратный переход, когда теплота подводится, происходит плавное размягчение до состояния жидкости.
Характерной особенностью микроструктуры кристаллов является пространственная периодичность их внутренних электрических полей и повторяемость в расположении кристаллообразующих частиц – атомов, ионов и молекул (дальний порядок). Частицы чередуются в определенном порядке вдоль прямых линий, которые называются узловыми. В любом плоском сечении кристалла две пересекающихся системы таких линий образуют совокупность совершенно одинаковых параллелограммов, которые плотно, без зазоров покрывают плоскость сечения. В пространстве пересечение трех некомпланарных систем таких линий образует пространственную сетку, которая разбивает кристалл на совокупность совершенно одинаковых параллелепипедов. Точки пересечения линий, образующих кристаллическую решетку называются узлами. Расстояния между узлами вдоль какого-то направления называется трансляциями или периодами решетки. Параллелепипед, построенный на трех некомпланарных трансляциях называется элементарной ячейкой или параллелепипедом повторяемости решетки. Важнейшим геометрическим свойством кристаллических решеток является симметрия в расположении частиц по отношению к определенным направлениям и плоскостям. По этой причине, хотя и существует несколько способов выбора элементарной ячейки, для данной кристаллической структуры, выбирают ее так, чтобы она соответствовала симметрии решетки.
|
|
|
Кристаллические тела можно разделить на две группы: монокристаллы и поликристаллы. Для монокристаллов наблюдается единая кристаллическая решетка в объеме всего тела. И хотя внешняя форма монокристаллов одного вида может быть разной, углы между соответствующими гранями будут всегда одинаковыми. Характерной особенностью монокристаллов является анизотропия механических, тепловых, электрических, оптических и др. свойств.
Монокристаллы нередко встречаются в естественном состоянии в природе. Например, большинство минералов – хрусталь, изумруды, рубины. В настоящее время в производственных целях многие монокристаллы выращивают искусственно из растворов и расплавов - рубины, германий, кремний, арсенид галия.
Один и тот же химический элемент может образовать несколько, отличающихся по геометрии, кристаллических структур. Это явление получило название - полиморфизма. Например, углерод – графит и алмаз; лед пять модификаций и др.
Правильная внешняя огранка и анизотропия свойств, как правило, не проявляются для кристаллических тел. Это объясняется тем, что кристаллические твердые тела обычно состоят из множества беспорядочно ориентированных мелких кристалликов. Такие твердые тела называются поликристаллическими. Связано это с механизмом кристаллизации: при достижении необходимых для этого процесса условий, очаги кристаллизации одновременно возникают во множестве мест исходной фазы. Зародившиеся кристаллы расположены и ориентированы друг по отношению к другу совершенно произвольно. По этой причине по окончании процесса мы получаем твердое тело в виде конгломерата сросшихся мелких кристалликов – кристаллитов.
С энергетической точки зрения различие между кристаллическими и аморфными твердыми телами хорошо прослеживаются в процессе отвердевания и плавления. Кристаллические тела имеют точку плавления – температуру, когда вещество устойчиво существует в двух фазах – твёрдой и жидкой (рис. кривая 2). Переход молекулы твердого тела в жидкость означает, что она приобретает дополнительно три степени свободы поступательного движения. Т.о. единица массы вещества при Тпл. в жидкой фазе имеет большую внутреннюю энергию, чем такая же масса в твердой фазе. Кроме того, меняется расстояние между частицами. Поэтому в целом количество теплоты необходимое для превращения единицы массы кристаллического вещества в жидкость будет:
λ = (Uж-Uкр ) + P (Vж-Vкр ),
где λ – удельная теплота плавления (кристаллизации), (Uж-Uкр) – разность внутренних энергий жидкой и кристаллической фаз, Р – внешнее давление, (Vж-Vкр) – разность удельных объемов. Согласно уравнению Клапейрона - Клаузиуса температура плавления зависит от давления:
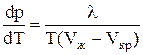 .
.
Видно, что если (Vж-Vкр)> 0, то 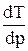 > 0, т.е. с ростом давления температура плавления повышается. Если же объем вещества при плавлении уменьшается (Vж-Vкр)< 0 (вода, висмут), то рост давления приводит к понижению Тпл.
> 0, т.е. с ростом давления температура плавления повышается. Если же объем вещества при плавлении уменьшается (Vж-Vкр)< 0 (вода, висмут), то рост давления приводит к понижению Тпл.
У аморфных тел теплота плавления отсутствует. Нагревание приводит к постепенному увеличению скорости теплового движения и уменьшению вязкости. На графике процесса имеется точка перегиба (рис.), которую условно называют температурой размягчения.
 2014-02-18
2014-02-18 2352
2352








