Для облегчения понимания межатомного взаимодействия мы будем рассматривать типы химической связи в несколько упрощенном виде, а именно, рассмотрим: а) гомеополярную, или ковалентную связь, б) гетерополярную, или ионную связь, в) металлическую связь и г) поляризационную связь, или связь Ван-дер-Ваальса.
Объединение атомов в молекулы вещества, а также объединение атомов или ионов в твердое тело происходит под действием химических связей. Объединение молекул в вещество, находящееся в жидком или газообразном состоянии осуществляется под действием сил межмолекулярного взаимодействия, называемыми силами Ван-дер-Ваальса. Природа химических и молекулярных связей единая – электрическая. Различают несколько типов химической связи, основные из них – это ковалентная и ионная.
Ковалентная связь осуществляется за счет образования одной или нескольких общих пар электронов, ранее принадлежавших разным атомам. Ковалентная связь может быть одинарной (водород, хлор) или многократной (например, азот – 3). Ковалентная связь образуется между атомами одного или нескольких химических элементов с близкими ионизационными потенциалами. В чистом виде ковалентная связь реализуется при взаимодействии элементов с наполовину заполненными электронными оболочками.
Рассмотрим схематическое строение атома и молекулы водорода, рис.1. Электроны при движении по орбитам чаще находятся между ядрами, что способствует сближению атомов. Радиус атома водорода равен 0,53 ангстрема, а расстояния между ядрами атомов в молекуле водорода равняется всего лишь 0,74 ангстрема.
 Появление между положительно заряженными ионами пары отрицательно заряженных электронов приводит к тому, что оба иона притягиваются к обобществленным электронам и, тем самым, притягиваются друг к другу. Каждый атом взаимодействует с ограниченным числом соседей, причем число соседей равно числу валентных электронов атома. Следовательно, ковалентная связь насыщенна. Кроме того, атом взаимодействует только с теми соседями, с которыми он обменялся электронами, то есть ковалентная связь направлена.
Появление между положительно заряженными ионами пары отрицательно заряженных электронов приводит к тому, что оба иона притягиваются к обобществленным электронам и, тем самым, притягиваются друг к другу. Каждый атом взаимодействует с ограниченным числом соседей, причем число соседей равно числу валентных электронов атома. Следовательно, ковалентная связь насыщенна. Кроме того, атом взаимодействует только с теми соседями, с которыми он обменялся электронами, то есть ковалентная связь направлена.
Отношение размера положительно заряженного ядра к размеру валентной электронной оболочки чрезвычайно мало, поэтому при анализе силы притяжения можно считать, что взаимодействуют точечные заряды, то есть сила притяжения описывается простейшим видом кулоновского закона: сила притяжения обратно пропорциональна квадрату расстояния между зарядами. При сближении атомов начинается взаимное отталкивание внутренних электронных оболочек, и отталкивание атомов описывается более сложным законом: сила отталкивания обратно пропорциональна расстоянию между атомами в степени n, где n >2.
Увеличение порядкового номера элемента ведет к росту количества электронных оболочек, экранирующих взаимодействие положительно заряженных ядер с валентными электронами. Поэтому снижается сила взаимного притяжения и уменьшается глубина потенциальной ямы. В результате, с ростом порядкового номера элемента падает температура плавления, растет коэффициент теплового расширения, уменьшается модуль упругости.
Если молекула состоит из атомов одного и того же химического элемента, то в ней центры расположения положительных и отрицательных зарядов совпадают. Собственный электрический дипольный момент μ такой молекулы равен нулю. Диэлектрик, образованный такими неполярными молекулами также является неполярным.
 Если молекула состоит из атомов различных химических элементов, то электронная пара сместится в сторону одного из атомов, обладающего большей электроотрицательностью. В результате произойдет поляризация молекулы. Полярной или дипольной станет и сама молекула. Электрический дипольный момент μ такой молекулы будет равен
Если молекула состоит из атомов различных химических элементов, то электронная пара сместится в сторону одного из атомов, обладающего большей электроотрицательностью. В результате произойдет поляризация молекулы. Полярной или дипольной станет и сама молекула. Электрический дипольный момент μ такой молекулы будет равен
μ = q * l, Кл*м
где q – абсолютное значение заряда диполя, l – плечо диполя, расстояние между центрами разноименных зарядов. Дипольный момент часто измеряют в дебаях(D). 1D = 3.33∙10 -30 Кл∙м. Молекула воды является полярной, так как электронные пары между кислородом и водородом смещены в сторону атома кислорода (рис. 2).
При наличии полярных ковалентных связей могут образовываться и неполярные молекулы, если дипольные моменты этих связей уравновешивают друг друга. Такое явление характерно для сложных органических молекул. Например, полиэтилен, трансформаторное масло, парафин являются неполярными веществами, хотя связь «углерод-водород» является полярной.
Ионная связь возникает между атомами, имеющими очень большую разность электроотрицательности. В этом случае электронная пара настолько сильно смещается в сторону одного из атомов, что тот фактически становится отрицательным ионом. Таким образом, ионная связь образуется за счет перехода электрона от одного атома молекулы к другому. Типичный пример такой связи – поваренная соль:
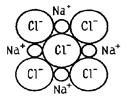 NaCl = Na+ + Cl-.
NaCl = Na+ + Cl-.
Границ между полярной ковалентной и ионной связью весьма условна, принципиального различия в механизме образования этих связей нет. Но эти связи сильно отличаются между собой по величине энергии, которую нужно затратить на разрыв такой связи.
Ионная связь образуется при взаимодействии атомов с малым количеством валентных электронов и атомов с большим количеством электронов на валентных оболочках. При этом наружные электроны атомов с низкими потенциалами ионизации переходят на валентные оболочки атомов с высокими ионизационными потенциалами. В результате образуются положительно и отрицательно заряженные ионы, взаимно притягивающиеся электростатическими силами. Ионная связь ненасыщенна, поскольку каждый из отрицательно заряженных ионов притягивает к себе положительно заряженные, а каждый из положительно заряженных ионов притягивает к себе все отрицательно заряженные. Однако ионная связь направлена, поскольку ион притягивает к себе разноименно заряженные ионы и отталкивает одноименно заряженные.
Уменьшение размера иона и увеличение его заряда ведет к росту энергии связи, а следовательно, к росту температуру плавления материала, уменьшению коэффициента теплового расширения и к увеличению модуля упругости.
Металлическая связь образуется между атомами одного или нескольких 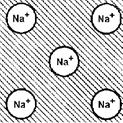 химических элементов, у которых валентные электронные оболочки застроены меньше чем на половину. Поскольку энергия иона минимальна при полностью заполненной внешней оболочке, атомы отдают внешние валентные электроны и превращаются в положительно заряженные ионы, между которыми находятся свободные электроны (электронный газ).
химических элементов, у которых валентные электронные оболочки застроены меньше чем на половину. Поскольку энергия иона минимальна при полностью заполненной внешней оболочке, атомы отдают внешние валентные электроны и превращаются в положительно заряженные ионы, между которыми находятся свободные электроны (электронный газ).
Каждый из положительно заряженных ионов притягивается к свободным электронам, и, тем самым, ионы притягиваются друг к другу. Металлическая связь ненаправлена и ненасыщена, и число ближайших соседей у иона определяется в основном геометрическим и энергетическими факторами. Следовательно, кристаллические решетки металлов упакованы плотно. Под действием электрического поля не связанные с ионами электроны перемещаются, то есть металлы обладают высокой электропроводностью. Свободные электроны могут легко ускоряться и замедляться, то есть менять свою кинетическую энергию. Вследствие этого металлические материалы поглощают кванты электромагнитного поля любой энергии, то есть металлы непрозрачны для радио- и световых волн в широком диапазоне частот. Поглотив квант электромагнитного поля, свободный электрон возбуждается, и, переходя в стационарное состояние, испускает аналогичный квант. Иначе говоря, металлические материалы отражают радио- и световые волны.
Поляризационная связь, или связь Ван-дер-Ваальса. Образуется при сближении молекул или атомов инертных газов. Рассмотрим возникновение поляризационной связи на примере инертных атомов.
У одиночного атома электронная оболочка симметрична. При сближении двух атомов их электронные оболочки электрически взаимодействуют и деформируются (см. рис. 6). В итоге атомы превращаются в диполи, которые взаимно притягиваются. Чем больше порядковый номер атома, тем больше у него электронных оболочек, а следовательно, связь валентных электронов с ядром ослабевает, и деформировать ее становится легче. Следовательно, возрастает дипольный момент атома и увеличивается энергия связи между атомами. Поэтому температура кипения тяжелых инертных газов заметно выше температуры кипения легких газов.
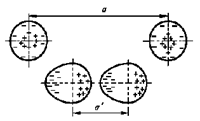 Аналогичные процессы происходят и при сближении электрически нейтральных молекул. Причем чем выше молекулярный вес, тем больший дипольный момент молекул и выше энергия связи. Поэтому вещества с низким молекулярным весом при комнатной температуре являются газами, вещества с большим молекулярным весом - жидкостями, а вещества с еще большим молекулярным весом - твердыми телами.
Аналогичные процессы происходят и при сближении электрически нейтральных молекул. Причем чем выше молекулярный вес, тем больший дипольный момент молекул и выше энергия связи. Поэтому вещества с низким молекулярным весом при комнатной температуре являются газами, вещества с большим молекулярным весом - жидкостями, а вещества с еще большим молекулярным весом - твердыми телами.
Важно иметь в виду, что в одном и том же материале одновременно могут реализовываться несколько типов химических связей. Так, внутри молекулы полиэтилена связь ковалентная, а между молекулами поляризационная. В алмазе атомы углерода связаны ковалентной связью, а у графита три электрона образуют ковалентную связь, один электрон идет на образование металлической связи, и образующиеся плоские молекулы связаны поляризационной связью.
В ряде случаев наблюдается изменение типа связи при изменении внешних условий. Так, олово является элементом четвертой группы, и в нем должна реализовываться ковалентная связь, но у олова пять электронных оболочек, и валентные электроны слабо связаны с ядром. Поэтому при термическом возбуждении электроны отрываются от атомов, и связь становится металлической. До температуры 13*С межатомная связь в олове ковалентная, и он является типичным полупроводником «серое» олово. Выше 13*С связь становится металлической, и олово ведет себя как типичный металл – «белое» олово. Важно отметить, что превращение белого олова в серое олово не может произойти строго при 13*С. Это вызвано существенным различием в плотности упаковки атомов. При перестройке кристаллических решеток в материале появляются упругие напряжения, которые повышают энергию системы. Поэтому превращение начинается при существенном переохлаждении. Упругие напряжения, возникающие при превращении, разрушают материал, поэтому серое олово существует в виде порошка. Превращение белого олова в серое было причиной гибели экспедиции Роберта Скотта. Поскольку канистры с горючим были пропаяны оловом, то при охлаждении белое олово превратилось в серое и горючее вытекло.
 2014-02-24
2014-02-24 8304
8304
