Давление насыщенного пара жидкостей
Испарение жидкости
Испарение – это процесс перехода молекул вещества со свободной поверхности жидкости в газовую фазу при температуре ниже точки кипения.
По мере нагревания жидкости достигается такая температура, при которой во всем объеме жидкости возникают пузырьки пара. Процесс парообразования при этом резко ускоряется. Его интенсивность определяется количеством тепла, подводимого к жидкости. Этот процесс называется кипением, а температура – соответственно, температурой кипения.
Чем выше температура кипения жидкости, тем при нормальных условиях меньше пара над ней образуется в единицу времени.
При испарении жидкости со свободной поверхности затраты энергии восполняются подводом тепла из окружающей среды, если ее температура выше, чем у жидкости. Если же исходные температуры жидкости и окружающего воздуха одинаковы, то испарение будет сопровождаться понижением внутренней энергии жидкости, что приводит к постепенному понижению ее температуры. Данное понижение тем больше, чем выше удельная теплота ее испарения и чем интенсивнее процесс парообразования. Так например, в комнатных условиях при испарении горючих жидкостей таких как СН3ОН (метанол), СН3СОСН3 (ацетон) и С2Н5ОС2Н5 (диэтиловый эфир) их температура понижается на 7-10 оС относительно окружающего воздуха. Эта закономерность сохраняется и при горении перечисленных выше веществ, поскольку затраты тепла на испарение не компенсируются тепловым потоком от факела пламени.
Если испарение протекает в закрытом сосуде, то через некоторое время наступает равновесие между числом молекул, покинувших и вернувшихся обратно в жидкость. Наступает динамическое равновесие. Пар, находящийся в динамическом равновесии с жидкостью, называется насыщенным паром.
Жидкости испаряются при любой температуре при наличии свободного объема. Испарение происходит с поверхности, причем тех молекул, которые имеют повышенную в 5-10 раз энергию по сравнению со средней.
Если испарение протекает в закрытом сосуде, то образующийся пар производит давление на стенки сосуда и жидкость, т.е. пар обладает давлением 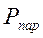 . Давление насыщенного пара является характерной величиной для жидкости при данной температуре и приводится в справочной литературе.
. Давление насыщенного пара является характерной величиной для жидкости при данной температуре и приводится в справочной литературе.
Давление насыщенного пара жидкости с повышением температуры увеличивается (рис. 8.2), и как только оно станет равным атмосферному, жидкость закипает. Из рис. 8.2 видно, что давление насыщенного пара закономерно повышается с увеличением температуры. При одинаковом внешнем давлении жидкости закипают при различной температуре, так как имеют неодинаковое давление насыщенного пара.

 ацетон этанол вода
ацетон этанол вода
Температура, оС
 |
Рис. 8.2 Зависимость давления насыщенного пара (Р×10-5 Па.) жидкости от температуры (ацетон, этиловый спирт, вода – соответственно).
Если изменить внешнее давление, то температура кипения жидкости будет изменяться. С повышением внешнего давления температура кипения увеличивается, а с понижением (вакуум) – уменьшается. При определенной величине внешнего давления жидкость может кипеть при комнатной температуре.
Зависимость давления насыщенного пара от температуры выражается уравнением Клаузиуса – Клапейрона
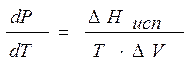 , (8.1)
, (8.1)
где 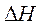 - мольная энтальпия испарения,
- мольная энтальпия испарения, 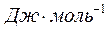 ;
; 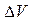 - мольное изменение объема в процессе испарения, равное
- мольное изменение объема в процессе испарения, равное 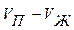 .
.
При испарении жидкости резко изменяется объем паровой фазы по сравнению с жидкой. Так, при испарении 1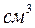 воды при 25 оС и давлении 760 мм рт. ст. образуется 1244
воды при 25 оС и давлении 760 мм рт. ст. образуется 1244 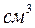 пара, т.е. объем увеличился в 1244 раза. Поэтому в уравнении объемом жидкости можно пренебречь:
пара, т.е. объем увеличился в 1244 раза. Поэтому в уравнении объемом жидкости можно пренебречь: 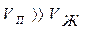 ,
, 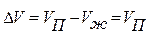 .
.
Тогда
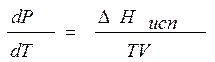 . (8.2)
. (8.2)
С учетом уравнения Менделеева–Клапейрона 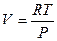 и тогда
и тогда

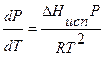 . (8.3)
. (8.3)
Интегрирование уравнения (8.3) приводит к формуле
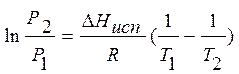 . (8.4)
. (8.4)
Эта формула носит имя двух ученых – Клаузиуса и Клапейрона, которые вывели ее из различных исходных положений.
Формула Клаузиуса–Клапейрона применима ко всем фазовым переходам, включая плавление, испарение и растворение вещества.
Теплота испарения жидкости 
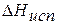 - это количество теплоты, поглощаемое жидкостью при изотермическом испарении. Различают мольную теплоту испарения и удельную теплоту испарения (относящуюся к 1 г жидкости). Чем выше теплота испарения, тем жидкость при прочих равных условиях испаряется медленнее, так как молекулам приходится преодолевать большие силы межмолекулярного взаимодействия.
- это количество теплоты, поглощаемое жидкостью при изотермическом испарении. Различают мольную теплоту испарения и удельную теплоту испарения (относящуюся к 1 г жидкости). Чем выше теплота испарения, тем жидкость при прочих равных условиях испаряется медленнее, так как молекулам приходится преодолевать большие силы межмолекулярного взаимодействия.
Сопоставление теплот испарения может быть более простым, если их рассматривать при постоянной температуре.
Для определения 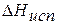 широко используется правило Трутона: мольная теплота испарения при атмосферном давлении (Р = const) различных жидкостей прямо пропорциональна их температуре кипения Ткип
широко используется правило Трутона: мольная теплота испарения при атмосферном давлении (Р = const) различных жидкостей прямо пропорциональна их температуре кипения Ткип
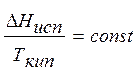 или
или 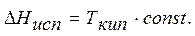
Коэффициент пропорциональности называется коэффициентом Трутона и для большинства нормальных (неассоциированных) жидкостей равен 88,2 - 92,4 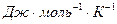 .
.
Теплота испарения данной жидкости зависит от температуры. С повышением температуры она понижается и при критической температуре становится равной нулю.
В инженерных расчетах используется эмпирическое уравнение Антуана
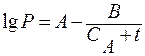 , (8.5)
, (8.5)
где А, В, 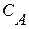 - константы, характеризующие вещество.
- константы, характеризующие вещество.
Найденные зависимости давления насыщенного пара от температуры используются в пожарно–технических расчетах для вычисления концентра- ции пара (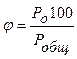 ; %), температурных пределов распространения пламени
; %), температурных пределов распространения пламени
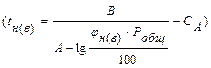 .
.
В условиях пожара жидкости испаряются в окружающее пространство. Скорость испарения жидкости при этом определяет скорость ее выгорания. В этом случае на скорость испарения решающее влияние оказывает количество тепла, поступающее из зоны горения.
Скорость выгорания жидкостей непостоянна. Она зависит от начальной температуры жидкости, диаметра резервуара, уровня жидкости в нем, скорости ветра и т.д.
 2014-02-24
2014-02-24 4891
4891
