Двойной суперфосфат – концентрированное фосфорное удобрение. Получаемое разложением природных фосфатов фосфорной кислотой. Оно содержит 42 – 50 % усвояемого P2O5, что в 2-3 раза больше, чем в простом суперфосфате. В отличие от последнего двойной суперфосфат почти не содержит балласта – сульфата кальция. Процесс протекает по уравнению (2).
Азотнокислое разложение фосфатов.
Получение сложных удобрений
Прогрессивным направлением в переработке фосфатного сырья является метод азотнокислого разложения апатитов и фосфоритов. Этот метод позволяет использовать азотную кислоту не только как средство разложения фосфоритов, но и дополнительный источник питательных элементов. На основе азотнокислого разложения фосфатов обычно получают сложные NP – или NPK-удобрения.
В основе процесса разложения фосфатов азотной кислотой лежит реакция
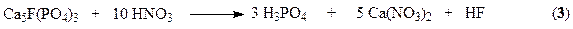
в результате которой образуется азотнокислая вытяжка, раствор, содержащий нитрат кальция и свободную фосфорную кислоту. Существует ряд методов дальнейшей переработки азотнокислой вытяжки. Во многих процессах вытяжку нейтрализуют аммиаком получая фосфаты аммония (NP-удобрения). Если перед гранулированием нейтрализованной пульпы к ней добавляют соли калия (KCl, K2SO4), то получают тройное NPK-удобрение – нитроаммофоску.
|
|
|
Во многих процессах азотнокислой переработки фосфатов нитрат кальция, образующийся в реакции (3), удаляют из реакционной смеси выпариванием. Разработка таких схем дает возможность комплексной переработки фосфатного сырья и создания практически безотходных производств, исключающих сброс отходов, в частности фосфогипса. Азотнокислый метод разложения фосфатов позволяет наряду с получением NPK-удобрений попутно выделять из сырья такие ценные продукты как стронций, редкоземельные элементы и др., находящие применение в различных отраслях промышленности (электроника, металлургия и т.д.).
7.4. Производство серной кислоты. Свойства, применение и способы получения серной кислоты. Производство сернистого газа. Контактный способ получения серной кислоты: теоретические основы процесса, устройство реакционных узлов и технологическая схема процесса
Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место. Объясняется это двумя причинами: ее дешевизной по сравнению со всеми другими кислотами, и ее свойствами. Серная кислота не дымит, в концентрированном виде не разрушает черные металлы, в то же время является одной из сильных кислот, в широком диапазоне температур
(– 40… – 20 260 – 336,5°С) находится в жидком состоянии.
|
|
|
Безводная серная кислота (моногидрат) представляет собой тяжелую маслянистую жидкость, которая смешивается с водой с выделением большого количества теплоты. Плотность H2SO4 при 0°С равна 1,85 г/см3, а температура кристаллизации 10,7°С.
Крупнейшими потребителями серной кислоты являются производства минеральных удобрений: суперфосфата, сульфата аммония.
Многие кислоты (фосфорная, уксусная, соляная, концентрированная азотная и др.) и соли производятся в значительной части при помощи серной кислоты.
Серная кислота широко применяется в производстве цветных и редких металлов, а также в металлообрабатывающей промышленности. Получение ряда красителей (для тканей), лаков и красок (для зданий и машин) лекарственных веществ и некоторых пластмасс также связано с применением серной кислоты. При помощи серной кислоты производят этиловый и другие спирты, некоторые эфиры, ПАВ, ряд ядохимикатов для борьбы с вредителями сельского хозяйства и сорными травами.
Разбавленные растворы серной кислоты и ее солей применяют в текстильной, а также в других отраслях легкой промышленности. В пищевой промышленности серная кислота применяется для получения крахмала, патоки и ряда других продуктов. В электротехнике она используется в качестве электролита в аккумуляторах. Серную кислоту используют для осушки газов и при концентрации кислот. Наконец, серную кислоту применяют как компонент реакционной среды в процессах нитрования, в частности, при получении взрывчатых веществ.
При нитровании, в производстве этилового спирта из этилена, при концентрировании азотной кислоты и в других процессах применяют серную кислоту концентрацией от 92 до 98%, а выводят из процесса разбавленную 50 – 80%-ную кислоту. Чтобы возвратить ее в новый цикл, полученные водные растворы упаривают.
Сырьевая база производства серной кислоты – серосодержащие соединения, из которых можно получить диоксид серы. В промышленности около 80% серной кислоты получают из природной серы и железного (серного) колчедана. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии. Некоторые производства используют в качестве сырья сероводород, образующийся при очистке серы в нефтепереработке. Первый обжиг серосодержащего сырья для получения диоксида серы.
Производство серной кислоты включает в себя следующую последовательность стадий:
Обжиг серного колчедана или серы.

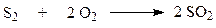
Окисление диоксида серы.
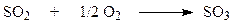
Абсорбция триоксида серы.
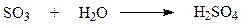
Исходные вещества – минеральное сырье – содержит примеси, поэтому выходящие со стадии обжига газы подвергаются очистке. Первая стадия – обжиг, специфичен для каждого вида сырья, и далее она будет рассматриваться для колчедана и серы как наиболее распространенных исходных веществ. Стадии окисления и абсорбции в основном одинаковы в разных способах получения серной кислоты. Поэтому эти стадии будут рассмотрены как типовые процессы.
Обжиг серосодержащего сырья.
Обжиг колчедана (пирита) является сложным физико-химическим процессом и включает в себя ряд последовательно или параллельно протекающих реакций:
| Термическая диссоциация | 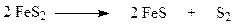
|
| Газофазное горение серы | 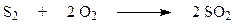
|
| Горение пирротина | 
|
| Или суммарно: | 
|
При небольшом избытке или недостатке кислорода образуется смешанный оксид железа

Обоснование роли параметров и их выбор.
Температура. Термическое разложение пирита начинается уже при температурах около 200°С и одновременно воспламеняется сера. При температурах выше 680°С интенсивно протекают все три реакции.
В промышленности обжиг ведут при 850 – 900°С, когда общая скорость процесса лимитируется массопереносом окислителя (кислорода) к поверхности пирита и продуктов разложения в газовую фазу. В общем виде движущая сила этого процесса может быть выражена уравнением
|
|
|
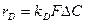 (1)
(1)
Из этого уравнения видно, что факторами увеличения производительности процесса являются интенсификация массопереноса (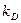 ), увеличение поверхности контакта фаз (F) и концентрации реагентов. Коэффициент массопереноса может быть увеличен повышением температуры, поверхность контакта фаз существенно возрастает с увеличением степени дисперсности твердого материала, а высокие концентрации реагентов обеспечиваются использованием обогащенного пирита и увеличением содержания кислорода в окислителе. Следует, однако, иметь в виду, что чрезмерное повышение температуры способствует размягчению и слипанию частиц твердого сырья, а применение концентрированных реагентов удорожает их стоимость и приводит к чрезмерному росту температуры в условиях автотермического режима. Это обусловливает выбор оптимальной температуры, сочетающей достаточную производительность процесса и использование сырья с соответствующим содержанием активных компонентов при минимуме процессов агломерации твердого материала. На практике процесс проводят при температуре 850 – 900°С.
), увеличение поверхности контакта фаз (F) и концентрации реагентов. Коэффициент массопереноса может быть увеличен повышением температуры, поверхность контакта фаз существенно возрастает с увеличением степени дисперсности твердого материала, а высокие концентрации реагентов обеспечиваются использованием обогащенного пирита и увеличением содержания кислорода в окислителе. Следует, однако, иметь в виду, что чрезмерное повышение температуры способствует размягчению и слипанию частиц твердого сырья, а применение концентрированных реагентов удорожает их стоимость и приводит к чрезмерному росту температуры в условиях автотермического режима. Это обусловливает выбор оптимальной температуры, сочетающей достаточную производительность процесса и использование сырья с соответствующим содержанием активных компонентов при минимуме процессов агломерации твердого материала. На практике процесс проводят при температуре 850 – 900°С.
Давление. В соответствии с уравнением (1) давление является фактором скорости процесса, однако его рост может привести в условиях автотермического режима к чрезмерному увеличению температуры и слипанию частиц твердого материала. Кроме того, увеличение давления приводит к увеличению расходов на компремирование. Поскольку реакция обжига в условиях указанных температур протекает достаточно гладко, то предпочитают работать при атмосферном давлении.
Соотношение воздух-колчедан поддерживается на уровне, обеспечивающем избыток кислорода по сравнению с его стехиометрическим количеством, с целью достижения высоких степеней обжига, однако этот избыток не должен быть чрезмерным, т.к. при значительных избытках рост степени извлечения серы из колчедана перекрывается значительным разбавлением газов обжига и понижением концентрации SO2 в них, что отрицательно влияет на последующий процесс окисления SO2 в SO3.
|
|
|
Ранее доминирующим типом реактора был многополочный реактор, снабженный скребками для выравнивания слоя на каждой полке и организации транспорта твердой фазы с верхних полок на нижние (см. типы реакторов для гетерогенных реакций с участием твердой фазы).
В таком реакторе степень дисперсности колчедана невелика, что существенно ограничивает производительность реактора. Кроме того, в таком реакторе движущиеся скребки в высокотемпературной зоне усложняют его конструкцию, создается неоднородный температурный режим по полкам, в нем трудно организовать отвод тепла из зоны реакции. Трудности теплосъема не позволяют получить обжиговый газ с концентрацией SO2 более 8 – 9%. Основное ограничение – невозможность использования мелких частиц, в то время как для гетерогенного процесса основной способ ускорения реакции – дробление частиц. По этой причине более перспективными являются аппараты к «кипящем слоем» твердых частиц. Их степень дисперсности позволяет на порядок ускорить процесс.
Пылевидный колчедан подается через питатель в реактор. Окислитель (воздух) подается снизу через распределительную решетку со скоростью, достаточной для взвешивания твердых частиц. Их витание в слое предотвращает слипание и способствует хорошему контакту с газом, выравнивает температурный режим по всему слою, обеспечивает подвижность твердого материала и его переток в выходной патрубок для вывода огарка из реактора. В слое подвижных частиц можно расположить теплообменные элементы. Благодаря увеличению глубины обжига содержание SO2 в обжиговом газе увеличивается до 13 – 15%. Основной недостаток печей кипящего слоя – повышенная запыленность обжигового газа из-за механической эрозии подвижных твердых частиц. Это требует более тщательной очистки газа от пыли в циклоне и электрофильтре.
Сжигание серы.
Сера – легкоплавкое вещество: температура ее плавления 113°С. Перед сжиганием ее расплавляют, используя пар, полученный при утилизации тепла ее сжигания. Расплавленная сера отстаивается и фильтруется для удаления имеющихся в природной сере примесей и насосом подается в печь сжигания. Сера горит в основном в парофазном состоянии. Чтобы обеспечить ее быстрое испарение, необходимо ее диспергировать в потоке воздух. Для этого используют форсуночные и циклонные печи. Первые оборудованы горизонтальными форсунками для тонкого распыления жидкости. В циклонной печи жидкая сера и воздух подаются тангенциально и за счет вихревого движения достигается диспергирование жидкости и перемешивание двух потоков. Мелкие капли быстро испаряются и сера в парообразном состоянии сгорает. Горение протекает адиабатически, и температура зависит от концентрации образующегося SO2.
За счет высокой теплоты сгорания серы температура в печи составляет более 1000°С. Этих условий достаточно для испарения жидкой серы. Печь сжигания работает в комплексе с вспомогательным оборудованием для плавления и фильтрования серы и котлом-утилизатором для использования тепла реакции.
Газы обжига колчедана содержат в виде примесей соединения фосфора, селена, теллура, мышьяка и некоторые другие, образующиеся из примесей сырья. Естественная влага сырья также переходит в газ. При горении образуются некоторое количество SO3 и возможно оксиды азота. Эти примеси приводят или к коррозии аппаратуры или к отравлению катализатора, а также ухудшают качество серной кислоты. Их удаляют в промывном отделении. Согласно схеме газ последовательно проходит две промывные башни, орошаемые растворами серной кислоты (60 и 20%-ой). В первой башне обжиговый газ охлаждается с 300 – 500°С до 60 – 70°С и освобождается от остатков пыли и части примесей. Эта башня полая. Обеспыленный газ отмывается 15 – 20%-ой серной кислотой от соединений As, Fe, Se во второй башне с насадкой. Окончательная осушка от влаги осуществляется в 3 – 9 башнях (сушильной), орошаемых концентрированной серной кислотой.
Окисление диоксида серы.
Реакция

является обратимой и экзотермической и протекает с уменьшением объема. Она осуществляется на катализаторах, основой которых является V2O5 с добавлением оксидов щелочных металлов, нанесенных на оксид кремния.
Обоснование роли параметров и их выбор.
Температура проходит максимум производительности, характерный для обратимых экзотермических реакций. Следует иметь в виду, что чрезмерное увеличение температуры может привести к диффузионному торможению процесса и это может повлиять на положение экстремума производительности и его величину.
В значительной степени выбор температуры определяется верхним и нижним пределом этого параметра. При Т<400 0C активность катализаторов весьма мала, а выше 600 0С происходит их термическая дезактивация. Оптимальными являются температуры, лежащие внутри этих пределов.
Давление является фактором скорости процесса и фактором смещения равновесия, однако на практике исходя из соображений экономии энергозатрат, а также благодаря возможности достичь высокой производите и степени превращения за счет использования других факторов предпочитают работать при давлениях, близких к атмосферному. Некоторое избыточное давление необходимо для преодоления гидравлических сопротивлений установки при организации транспортных потоков реагентов.
Соотношение O2:SO2. является фактором смещения равновесия, а также фактором скорости процесса в соответствии с уравнением Борескова
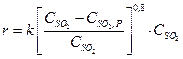 (2)
(2)
Однако сверху это соотношение ограничивается замедлением роста скорости при высоких 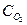 и значительным снижением содержания SO2 в контактных газах, поступающих на абсорбцию, что снижает эффективность последней. На практике используют избыток О2 более чем полтора по отношению к стехиометрическому.
и значительным снижением содержания SO2 в контактных газах, поступающих на абсорбцию, что снижает эффективность последней. На практике используют избыток О2 более чем полтора по отношению к стехиометрическому.
Время контакта выбирается, исходя из максимально достижимой конверсии. Пределом такой конверсии является максимальная степень превращения, при которой скорость процесса близка к нулю. Поэтому за время реакции выбирается то минимальное время, при котором степень конверсии практически близка равновесной. Обычно эта величина равна 90-95 %, а соответствующее ей время – несколько секунд.
Технология контактного окисления SO2.
Чаще всего в промышленности используют полочные аппараты со съемом тепла реакции между полками. Схема теплообменника предполагает максимальное использование тепла реакции для подогрева исходного газа. При этом съем тепла между полками осуществляют в той мере, которая позволяет приближать рабочую температуру к оптимальному значению этого параметра.
Одна из важнейших задач производства серной кислоты состоит в увеличении степени превращения диоксида серы и снижения его выбросов в атмосферу. Эта задача может быть решена несколькими методами.
Один из наиболее рациональных методов решения этой задачи – метод двойного контактирования и двойной абсорбции (ДКДА). Его сущность состоит в том, что реакционную смесь, в которой степень превращения SO2 составляет 90 – 95%, охлаждают и направляют в промежуточный абсорбер для выделения SO3; в оставшемся реакционном газе соотношение O2: SO2 существенно повышается, что приводит к смещению равновесия реакции вправо. Вновь нагретый реакционный газ опять подают в контактный аппарат, где на достигается 95% степень превращения оставшегося SO2. Суммарная степень превращения SO2 в таком процессе достигает 99,5 – 99,8%.
Абсорбция триоксида серы.
Абсорбция триоксида серы – последняя стадия процесса на которой образуется серная кислота. Взаимодействие SO3 с водой
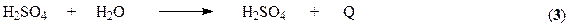
протекает достаточно интенсивно как в жидкой, так и в газовой фазе. Кроме того H2SO4 может растворять в себе SO3, образуя олеум. Этот продукт удобен для транспортировки, поскольку он не вызывает коррозии даже обычных сталей. В то же время растворы серной кислоты чрезвычайно агрессивны.
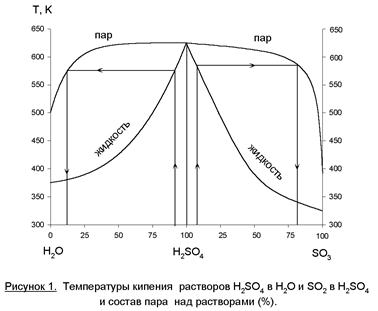
Равновесие «газ-жидкость» для «H2O-H2SO4-SO3» представлено на рисунке 1. Особенностью этой системы является то, что в широком интервале концентраций раствора серной кислоты в паровой фазе присутствуют чистые пары воды, а над олеумом – в газовой фазе преобладает SO3. Одинаковый состав жидкой и паровой фаз (азеотропная точка) будет при концентрации серной кислоты 98,3%. Если SO3 поглощать раствором с меньшей концентрацией, то реакция (3) будет протекать и в паровой фазе – будет образовываться туман серной кислоты, который уйдет из абсорбера с газовой фазой. А это – и потери продукта, и коррозия аппаратуры, и выбросы в атмосферу. Если SO3 абсорбировать олеумом, то поглощение будет неполным.
Из этих двух свойств следует двухстадийная схема абсорбции (рисунок 2). Газ, содержащий SO3 после реактора проходит последовательно олеумый (1) и моногидратный (2) абсорберы. Другой компонент реакции (H2O) подается противотоком через сборник в моногидратный абсорбер. За счет интенсивной циркуляции жидкости (абсорбата) в ней можно поддерживать близкую к оптимальной концентрацию H2SO4 – 98,3% (увеличение 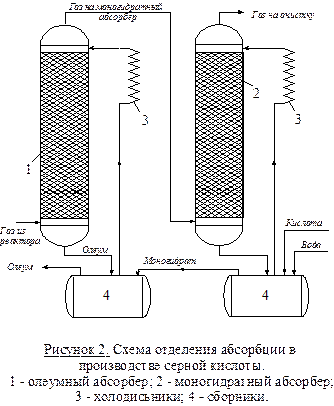 концентрации за проход жидкости не более 1 – 1,5%). Концентрационные условия абсорбции обеспечиваю полное поглощение SO3 и минимальное образование сернокислого тумана. Кислота из моногидратного абсорбера поступает в олеумный. В нем циркулирует 20% раствор Н2SO4, который частично отбирается как конечный продукт – олеум. Кислота из предыдущего абсорбера – моногидрат – также может быть продуктом. В системе циркуляции предусмотрены холодильники для съема тепла реакции и обеспечения более эффективной абсорбции. При температурах меньше 100°С SO3 поглощается практически полностью, диоксид серы – практически не поглощается.
концентрации за проход жидкости не более 1 – 1,5%). Концентрационные условия абсорбции обеспечиваю полное поглощение SO3 и минимальное образование сернокислого тумана. Кислота из моногидратного абсорбера поступает в олеумный. В нем циркулирует 20% раствор Н2SO4, который частично отбирается как конечный продукт – олеум. Кислота из предыдущего абсорбера – моногидрат – также может быть продуктом. В системе циркуляции предусмотрены холодильники для съема тепла реакции и обеспечения более эффективной абсорбции. При температурах меньше 100°С SO3 поглощается практически полностью, диоксид серы – практически не поглощается.
 2014-02-12
2014-02-12 2373
2373
