Химикам известно довольно много объектов, химическое строение которых в принципе не может быть описано с позиций МВС.
Пример №1. Известно, что молекулярный ион H2+ - устойчивая частица. Каким образом здесь осуществляется ковалентная хим. связь, если в данной частице присутствует только 1 электрон?
Пример №2. Простейший бороводород BH3 не существует, т.к. в момент образования он мгновенно димеризуется в молекулу B2H6. Каким образом здесь осуществляется ковалентная хим. связь, если каждый атом водорода одновалентен, а каждый атом бора должен быть трехвалентным (у бора 3 валентных электрона)?
Пример №3. По МВС молекулы О2 не должна содержать неспаренные электроны. Такие молекулы должны проявлять диамагнитные свойства (выталкиваться из магнитного поля). Эксперимент показывает обратное: молекулы О2 втягиваются в магнитное поле Þ О2 парамагнитна, т.е. содержит 1 или несколько неспаренных электронов.
И таких примеров можно привести еще немало. Все эти явления легко объяснимы в рамках другого квантовомеханического способа описания хим.связи – ММО.
В ММО молекула (или любая другая частица) рассматривается как единое целое.
Фактически, ММО рассматривает молекулу как «многоядерный атом». Другими словами: при образовании молекулы исходные атомы исчезают, т.к. превращаются в «многоядерный атом». В таком «многоядерном атоме» тоже существуют орбитали, которые называются молекулярными орбиталями (МО).
МО получаются при взаимодействии АО исходных атомов.
МО отличаются от АО по энергии, форме и ориентации в пространстве (напрашивается аналогия с ГАО, но она мнимая).
В образовании каждой МО молекулы принимают участие все исходные АО всех атомов, объединяющихся в молекулу. Но вклад каждой АО в образование данной МО различен. Наиболее сильно взаимодействуют АО, которые:
а) близки по энергии
б) имеют одинаковую форму (s+s, p+p, d+d)
в) одинаково ориентированы в пространстве (px+px, py+py и т.д.).
При образовании МО соблюдается правило сохранения количества орбиталей: количество получившихся МО = количеству исходных АО.
Результатом расчета по ММО является энергетическая диаграмма, которая показывает взаимное расположение энергетических уровней МО относительно исходных АО.
Пример: энергетическая диаграмма для молекулы H2
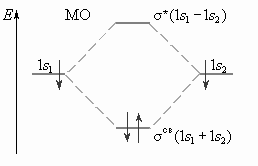
МО, которые имеют энергию ниже, чем исходные АО называются связывающими.
МО, имеющие энергию выше, чем исходные АО называются разрыхляющими (*).
Заполнение МО электронами МО осуществляется по тем же законам, как и в атоме:
1. Принцип наименьшей энергии.
2. Принцип Паули.
3. Правило Хунда.
В ММО невозможно определить число связей между атомами в молекуле (химическая связь в ММО является понятием несчетным!). Вместо этого здесь используется понятие о порядке связи (ПС):
ПС=(Nсв-Nразр)/m,
где: Nсв - кол-во электронов на СМО,
Nразр - кол-во электронов на РМО,
m - кол-во ядер в молекуле.
Чем больше ПС, тем крепче, прочнее частица (молекула, ион, радикал).
Если ПС ≤ 0, то связи вообще нет, т.е. данная частица существовать не может.
Например: ПС (H2) = (2-0)/2 = 1 Þ молекула H2 устойчивая частица.
Далее разобрать:
ПС (H2+) = (1-0)/2 = 1/2 > 0 Þ H2+ устойчивая частица
ПС (H2+2) = (0-0)/2 = 0 Þ H2+2 не существует
ПС (H2-) = (2-1)/2 = 1/2 > 0 Þ H2- устойчивая частица
ПС (H2-2) = (2-2)/2 = 0 Þ H2-2 не существует
 2014-02-12
2014-02-12 4136
4136
