Как было отмечено выше, в критическом состоянии нет различия между жидкостью и газом, нет границы раздела между этими фазами. На диаграмме Ван-дер-Ваальса критическое состояние вещества изображается точкой перегиба К. Критическое состояние можно описать при помощи критических параметров состояния: критической температуры Тк, критического объёма Vк и критического давления Рк. Критические параметры можно выразить через поправки на давление и объём. Поскольку критическая точка – точка перегиба изотермы Ван-дер-Ваальса, то в этой точке первая и вторая производные от давления по объёму должны быть равны нулю. Поскольку состояние реального газа описывается уравнением Ван-дер-Ваальса, то первая производная определяется формулой:
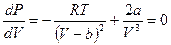 (6.5)
(6.5)
Вторая производная: 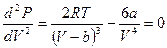 .
.
Приведём к общему знаменателю обе формулы и их числители приравняем нулю, получим: 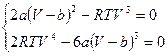 .
.
Преобразуем эту систему к уравнению: 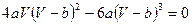 . Поделим обе части этого уравнения на
. Поделим обе части этого уравнения на 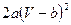 и получим:
и получим:
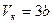 (6.6)
(6.6)
На практике обычно  . Для выражения критической температуры через поправки на объём и давление, воспользуемся формулой (6.5)и получим
. Для выражения критической температуры через поправки на объём и давление, воспользуемся формулой (6.5)и получим 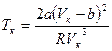 . Подставим в эту формулу вместо критического объёма правую часть равенства (6.6) и получим:
. Подставим в эту формулу вместо критического объёма правую часть равенства (6.6) и получим:
|
|
|
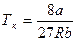 (6.7)
(6.7)
Следует обратить внимание на то, что критическая температура вещества не равна температуре кипения. Так температура кипения воды 373,15 К, а критическая температура 647,25 К. Ниже приведены критические температуры некоторых веществ.
| Вещество | Критическая температура, К |
| Вода (водяной пар) | 647,25 |
| Кислород | 154,3 |
| Азот |
Критическое давление найдём, подставив в уравнение 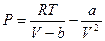 критический объём и критическую температуру, выраженные через поправки Ван-дер-Ваальса, получим:
критический объём и критическую температуру, выраженные через поправки Ван-дер-Ваальса, получим:
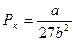 (6.8)
(6.8)
Следует отметить, что для одного моля идеального газа справедливо равенство 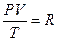 . Поскольку в критическом состоянии газ нельзя считать идеальным, то приведённое выше равенство не выполняется, а справедливо следующее равенство:
. Поскольку в критическом состоянии газ нельзя считать идеальным, то приведённое выше равенство не выполняется, а справедливо следующее равенство:
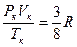 (6.9)
(6.9)
При критических параметрах парообразное и жидкое состояния неразличимы. Однако, если при критической температуре  , вещество находится в газообразном состоянии, а при
, вещество находится в газообразном состоянии, а при 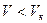 - в жидком. Критические параметры обычно определяют экспериментально и по ним рассчитывают поправки Ван-дер-Ваальса. Для многих веществ трудно экспериментально измерить критические параметры. В этом случае критические параметры рассчитывают, используя экспериментально полученные критические параметры другого вещества, и уравнение Ван-дер-Ваальса в приведённых или относительных параметрах:
- в жидком. Критические параметры обычно определяют экспериментально и по ним рассчитывают поправки Ван-дер-Ваальса. Для многих веществ трудно экспериментально измерить критические параметры. В этом случае критические параметры рассчитывают, используя экспериментально полученные критические параметры другого вещества, и уравнение Ван-дер-Ваальса в приведённых или относительных параметрах: 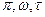 , где
, где 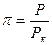 ,
, 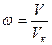 и
и 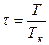 . Уравнение Ван-дер-Ваальса в приведённых или относительных параметрах имеет вид для одного моля:
. Уравнение Ван-дер-Ваальса в приведённых или относительных параметрах имеет вид для одного моля:
|
|
|
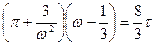 (6.10)
(6.10)
Таким образом, изучение поведения уравнения (6.10) позволяет предсказать поведение любого реального газа.
6.5 Внутренняя энергия и теплоёмкость реального газа
Внутренняя энергия и теплоёмкость реального газа определяется кинетической энергией теплового движения его молекул и потенциальной энергией их взаимодействия:
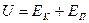 (6.11)
(6.11)
Для одного моля газа 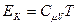 . Потенциальную энергию определим, если учтём, что элементарная работа сил молекулярного взаимодействия при постоянной температуре определяется по формуле:
. Потенциальную энергию определим, если учтём, что элементарная работа сил молекулярного взаимодействия при постоянной температуре определяется по формуле: 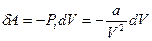 . Эта работа связана с изменением потенциальной энергии известным равенством:
. Эта работа связана с изменением потенциальной энергии известным равенством:  . Тогда
. Тогда 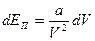 . Интегрируя это выражение, получим:
. Интегрируя это выражение, получим: 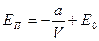 . Примем ЕП=0 при
. Примем ЕП=0 при 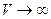 , следовательно, Е0 = 0. Тогда потенциальная энергия одного моля реального газа будет определяться формулой:
, следовательно, Е0 = 0. Тогда потенциальная энергия одного моля реального газа будет определяться формулой:
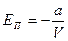 (6.12)
(6.12)
С учётом этого внутренняя энергия одного моля реального газа равна:
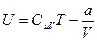 (6.13)
(6.13)
Таким образом, внутренняя энергия реального газа зависит не только от температуры, но и от объёма. Температура реального газа может меняться даже в том случае, когда его внутренняя энергия остаётся постоянной.
Определим теплоёмкость реального газа. Согласно определению, теплоёмкость газа определяется формулой:
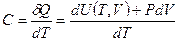 (6.14)
(6.14)
Для реального газа 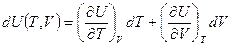 . С учётом этого, теплоёмкость реального газа будет определяться формулой:
. С учётом этого, теплоёмкость реального газа будет определяться формулой:
 (6.15)
(6.15)
Рассмотрим частные случаи. Определим молярную теплоёмкость при постоянном объёме для реального газа. Так как изменение объёма равно нулю, то второе слагаемое в уравнении (6.15) тоже будет равно нулю, а теплоёмкость будет такой же, как и у идеального газа:
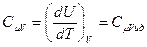 (6.16)
(6.16)
Молярная теплоёмкость при постоянном давлении для реального газа будет отличаться от таковой для идеального газа вследствие учёта взаимодействия между молекулами и будет определяться по формуле:
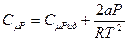 (6.17)
(6.17)
Разность между молярными теплоёмкостями реального газа уже не будет равна универсальной газовой постоянной, а будет определяться выражением:
 (6.18)
(6.18)
Показатель адиабаты тоже будет отличаться от показателя для идеального газа:
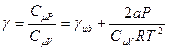 (6.19)
(6.19)
В отличие от идеальных газов 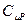 и g для реального газа Ван-дер-Ваальса зависит от температуры и давления, и заметно отличаются от значений для идеального газа при высоких давлениях и низких температурах, поскольку второе слагаемое в уравнении (6.19) при этом растёт.
и g для реального газа Ван-дер-Ваальса зависит от температуры и давления, и заметно отличаются от значений для идеального газа при высоких давлениях и низких температурах, поскольку второе слагаемое в уравнении (6.19) при этом растёт.
 2014-02-13
2014-02-13 4949
4949
