Цель работы: экспериментально определить молекулярную массу оксида углерода (IV).
Определение молярной массы газа может быть выполнено несколькими способами.
Чаще всего его определяют исходя из абсолютной и относительной плотности газов.
Абсолютной плотностью газа 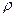 называется масса единицы объёма газа при нормальных условиях; за единицу объёма газа обычно принимают 1 л. Зная массу 1 л газа при нормальных условиях и его молярный объём (22,4 л), определяют молярную массу газа М.
называется масса единицы объёма газа при нормальных условиях; за единицу объёма газа обычно принимают 1 л. Зная массу 1 л газа при нормальных условиях и его молярный объём (22,4 л), определяют молярную массу газа М.
М = 22,4 ∙ 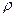
Для приведения объёма, газа к нормальным условиям используют уравнение газового состояния
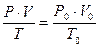 или
или 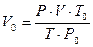 ,
,
где V – объёма газа, измеренный при реальных условиях, т.е. при атмосферном давлении P и температуре Т .
Относительной плотностью D первого газа по второму называют отношение плотностей этих газов
D = 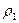 /
/ 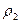 ,
,
где 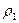 - плотность первого газа,
- плотность первого газа,
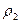 - плотность второго газа,
- плотность второго газа,
Это отношение можно заменить отношение масс газов, содержащихся в одинаковых объёмах при одинаковой температуре
D = 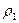 /
/ 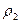 = m1 / m2,
= m1 / m2,
где m1 - масса первого газа,
|
|
|
m2 – масса второго газа.
По закону Авогадро в одинаковых объёмах любых газов при одних и тех же условиях содержится равное число молекул. Следовательно, их массы относятся друг к другу как их молярные массы
m1 / m2 = М1 / М2.
Так как m1 / m2 – плотность первого газа по второму, то
D = М1 / М2, тогда M1 = M2∙D
Молярную массу газа можно вычислить также, пользуясь уравнением Менделеева – Клайперона
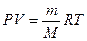 или
или 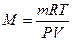 ,
,
где P – давление, Па;
V –, м3;
m – масса, кг;
М – молярная масса, кг/моль;
R - молярная газовая постоянная, равная 8,314 Дж/(моль∙К);
Т – абсолютная температура, К.
Экспериментальная часть
Определение молекулярной массы оксида углерода (IV).
Определение молекулярной массы оксида углерода (IV) проводится в приборе, изображённом на рис.1. Оксид углерода (IV) получается в аппарате Киппа действием 10%-ой соляной кислоты на мрамор:
CaCO3 + 2HCl = CaCl2 + H2O + CO2.
Оксид углерода (IV) подвергают очистке, пропуская последовательно через растворы NaHCO3 и H2SO4.
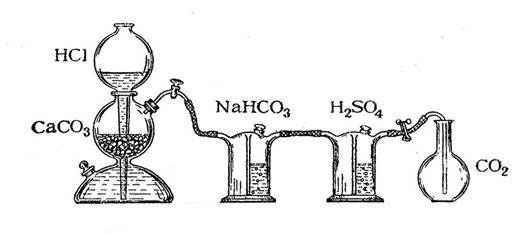
Рисунок 1. Аппарат Кипа
Взвесить колбу с пробкой на технохимических весах с точностью до 0,01г. Данные записать. Наполнить колбу оксидом углерода (IV), опустив газоотводную трубку до дна колбы. Закрыть колбу пробкой (пробка должна входить на ту же глубину, что при взвешивании колбы) и вновь взвесить. Чтобы быть уверенным в том, что воздух из колбы полностью вытеснен, и она целиком наполнена оксидом углерода (IV), надо, взвесив колбу, ещё раз на несколько минут опустить в неё газоотводную трубку, опустить и вновь взвесить колбу, повторяя эту операцию до получения постоянной массы колбы. Массу колбы с оксидом углерода (IV) записать. Определить объём колбы, наполнив её водой до пробки, затем измерить объём воды мерным цилиндром и записать результаты. Отметить и записать показания термометра и барометра во время опыта.
|
|
|
Форма записи наблюдений и обработка результатов.
| 1. | Масса колбы (с пробкой) с воздухом – m1, г | |
| 2. | Масса колбы (с пробкой) с оксидом углерода (IV) – m2, г | |
| 3. | Объём колбы – V, мл | |
| 4. | Температура – t, 0С | |
| 5. | Давление – Р1, мм рт.ст. |
По полученным данным вычислить молекулярную массу оксида углерода (IV) с помощью уравнения Менделеева – Клапейрона, исходя из относительной плотности оксида углерода (IV) по водороду, если известно, что масса 1л Н2 при н.у. 0,09г.
В конце опыта вычислить относительную ошибку в процентах:
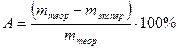
Вопросы и задачи.
1. Как следует формулировать закон Авогадро? Что показывает число Авогадро?
2. Что называется относительной плотностью газа?
3. Как можно вычислить молекулярную массу вещества, зная плотность его паров по воздуху?
4. Какова плотность по воздуху азота N2, хлора Сl2 и оксида углерода (II) СО?
5. Что тяжелее: сухой углекислый газ или равный объём того же газа, содержащего водяные пары?
6. Масса 1 л газа при нормальных условиях 1,43 г. Чему равна молекулярная масса газа?
7. Вычислить молекулярную массу газа, если относительную плотность его по воздуху равна 0,966.
8. Плотность газа по воздуху 1,17. Определить молекулярную массу газа.
9. Вычислить относительную плотность по воздуху газов: NH3, CH4, N2.
10. Вычислить относительную плотность по воздуху газов: N2O, NO, F2.
11. Вычислить какой объём (н.у.) займут 3,5 г азота; 640 г кислорода; 110 г углекислого газа; 70 г оксида углерода?
12. Какие объёмы занимают при н.у. следующие количества газов: 1 г водорода; 1 г кислорода и 1 г углекислого газа?
13. Сколько молекул содержится в 1 мл водорода при н.у.?
14. Плотность газа по водороду 17. Какова масса 1 л этого газа при н.у.? Какова его плотность по воздуху?
15. Плотность газа по воздуху 1,52. Какой объём займут при н.у. 5,5 г этого газа?
16. Какой объём займут 2∙1023 молекул хлора при 27 0С и 600 мм рт. ст.
17. Масса 87 мл пара при 62 0С и 758 мм рт. ст. равна 0,24 г. Вычислить молекулярную массу вещества.
18. Вычислить массу 1 м3 воздуха при 17 0С и 624 мм рт. ст.
19. Вычислить объём, который займёт при 17 0С и 1 атм. 1кг воздуха.
20. Из опыта найдено, что газ, собранный над водой, при 25 0С имеет объём 600 мл при атмосферном давлении 97,325 кПа. Вычислить, чему равен объём сухого газа при нормальных условиях.
21. В стальном баллоне ёмкостью 20 л находится кислород под давлением в 12 кПа при температуре 17 0С. Вычислите массу кислорода в баллоне.
22. Вычислите молекулярную массу газа тремя различным способами, если известно, что массы 1 л воздуха и водорода при н.у., соответственно равны 1,29 и 0,09 г, а масса 1 л газообразного вещества при тех же условиях равна: а) 3,57 г; б) 0,76 г; в) 3,17 г; г)2,058 г; д) 4,82 г; е) 1,965 г; ж) 1,25 г; з) 2,86 г.
Работа №2
 2015-01-07
2015-01-07 6045
6045
