Термохимия изучает тепловые эффекты химических процессов. Химические реакции сопровождаются выделением или поглощением энергии в виде теплоты. Уравнения реакций, в которых учитываются их тепловые эффекты, называют термохимическими. В этих уравнениях выделение теплоты обозначают знаком (+), а поглощение (-).
В термодинамике принята обратная система знаков, и выделение теплоты обозначают знаком (-), а поглощение знаком (+). Агрегатные состояния веществ (К – кристалл, Ж – жидкость, Г – газ) обозначаются буквами у химических символов реагентов.
Основными понятиями термохимии являются теплота образования, теплота разложения, теплота сгорания.
Теплотой образования соединения называется количество выделяемой или поглощаемой теплоты при образовании одного моля соединения из простых веществ.
Теплотой разложения соединения называется количество теплоты, которое поглощается или выделяется при разложении одного моля соединения на простые вещества.
Теплотой сгорания соединения называется количество теплоты, которое выделяется при сгорании вещества количеством вещества один моль.
|
|
|
В качестве стандартных условий в термодинамике принимается температура 25 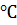 (298 К) и давление 1,013 ×
(298 К) и давление 1,013 × 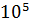 Па. Теплоты образования в этих условиях называют стандартными, для многих веществ они приводятся в таблицах справочной литературы.
Па. Теплоты образования в этих условиях называют стандартными, для многих веществ они приводятся в таблицах справочной литературы.
Основным законом термохимии является закон Гесса (1840): тепловой эффект (энтальпия) химических реакций, протекающих при постоянном объеме или при постоянном давлении, не зависит от числа промежуточных стадий и определяется только по начальным и конечным состояниям системы.
Следствие из закона Гесса: тепловой эффект реакции равен сумме теплот (энтальпии) образования продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом стехиометрических коэффициентов перед формулами этих веществ в управлении реакции.
Тепловые эффекты химических реакций связаны с изменением внутренней энергии системы при переходе от исходных веществ к продуктам реакции. Теплота Q, поглощаемая системой, идет на изменение ее внутренней энергии  U и на совершение работы A.
U и на совершение работы A.
Q=  U+A
U+A
Внутренняя энергия является функцией состояния, т.е. ее изменение определяется начальным и конечным состоянием системы и не зависит от пути перехода, по которому протекает процесс.
 U=
U= 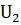 -
- 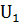
Работа, которую совершает химическая система против внешних сил, равна произведению давления Р на изменение объема =  V системы:
V системы:
A=P(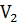 -
- 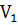 )=P
)=P  V
V
При изохорном процессе А=0, т.е. изменения объема системы не происходит. Тогда Q= 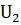 -
- 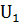 =
=  U.
U.
Для изобарического процесса тепловой эффект равен 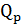 =
=  U+ P
U+ P  V, где
V, где  V - изменение объема системы.
V - изменение объема системы.
|
|
|
 V=∑
V=∑ 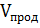 -∑
-∑ 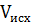
Тогда 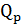 =(
=(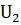 -
- 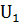 )+P(
)+P(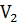 -
- 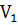 )
)
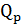 =(
=(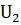 +
+ 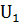 )-P(
)-P(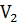 +
+ 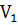 )
)
Введем обозначение U+PV=H
Тогда 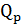 =
= 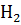 -
- 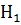 =
=  H
H
Величина H называется энтальпией (теплосодержанием).
Таким образом, для реакции аА+bB+…=dD+eE…
Тепловой эффект изохорного процесса
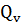 =
=  U=
U= 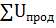 -∑
-∑ 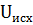
Изобарного процесса
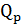 =
=  H=
H= 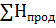 -∑
-∑ 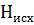
Энтальпия, как и внутренняя энергия, аддитивная величина, которая не зависит от промежуточных стадий реакции и определятся только начальным и конечным состоянием системы:
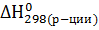 =
= 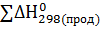 -
- 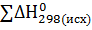
где 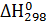 – энтальпия образования соединения из простых веществ при температуре 298
– энтальпия образования соединения из простых веществ при температуре 298  K.
K.
Пример1. Расчет теплового эффекта химических реакции по теплоте образования реагирующих веществ и продуктов реакции.
Определите количество теплоты, выделяющейся при гашении 100 кг извести водой при 25 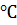 , если известны стандартные теплоты образования веществ, участвующих в химической реакции:
, если известны стандартные теплоты образования веществ, участвующих в химической реакции:
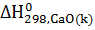 =-635,1кДж
=-635,1кДж 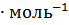 ;
;
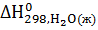 =-285,84кДж ∙
=-285,84кДж ∙ 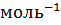 ;
;
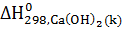 =-986,2кДж
=-986,2кДж 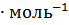 ;
;
Решение. Реакция гашения извести: 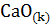 +
+ 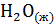 =
= 
Согласно первому следствию из закона Гесса тепловой эффект химической реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования реагирующих веществ с учетом стехиометрических коэффициентов:
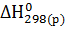 =
= 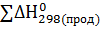 -
- 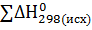
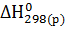 =
= 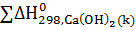 -
- 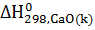 -
- 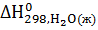 =
=
=-986,2-(-635,1)-(-285,84)=-65,26кДж 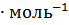
Таким образом, при гашении водой 1 моль извести выделяется 65,26 кДж, при гашении 1 кмоль – 65260 кДж.
M(CaO)=56г 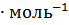 =56кг
=56кг  к
к 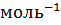 ; m(CaO)=100кг
; m(CaO)=100кг
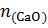 =
= 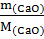
При гашении водой 100 кг извести выделяется 100/56  116536 кДж
116536 кДж
Пример 2. Расчет теплоты образования.
Определить теплоту образования Ca 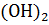 тв на основе реакций:
тв на основе реакций:
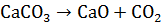 +
+ 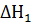
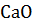 +
+ 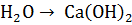 тв +
тв + 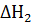
Решение. Для определения суммарной теплоты образования 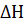 для этой реакции определяем
для этой реакции определяем 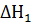 и
и 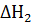 , тогда
, тогда 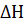 =
= 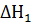 +
+ 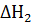 ;
;
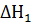 =
= 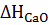 +
+ 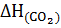 -
- 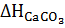 =+177,83 кДж
=+177,83 кДж 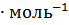
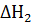 =
= 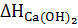 -
- 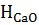 -
- 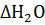 =-65,2 кДж
=-65,2 кДж 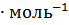
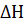 =+177,83-65,2=+113,61 кДж
=+177,83-65,2=+113,61 кДж 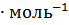
Пример 3. Расчет теплоты образования вещества по теплоте реакции и теплоте разложения веществ.
Определить теплоту образования алюмината бария – главной составной части бариевого огнеупорного цемента из 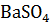 и α
и α 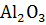 .
.
Решение. Для определения искомой величины надо знать теплоту 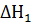 реакции
реакции 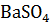 +
+ 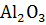 и теплоту
и теплоту 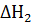 разложения
разложения 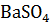 .
.
Найдя разности 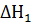 +
+ 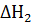 , получим теплоту образования BaO
, получим теплоту образования BaO 
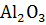 ;
;
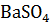 +
+ 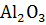 = BaO
= BaO 
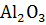 +
+ 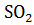 +1/2
+1/2 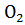 + 566,05 кДж
+ 566,05 кДж 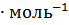 ;
;
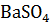 = BaO +
= BaO + 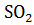 + 1/2
+ 1/2 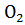 + 566,05 кДж
+ 566,05 кДж 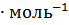
Пример 4. Определение теплоты разложения.
Определить, сколько теплоты нужно затратить на разложение 5 кг 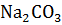 , протекающее по уравнению
, протекающее по уравнению 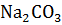 =
= 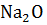 +
+ 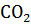 , на основании следующих данных:
, на основании следующих данных:
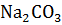 +
+ 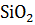 =
= 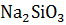 +
+ 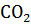 – 81035,7 Дж
– 81035,7 Дж
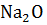 +
+ 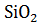 =
= 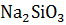 + 243174,1 Дж
+ 243174,1 Дж
Решение. На основании приведенных термохимических уравнений находим искомое термохимическое уравнение
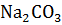 +
+ 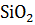 =
= 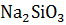 +
+ 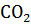 – 81035,7 Дж
– 81035,7 Дж
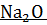 +
+ 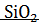 =
= 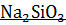 + 243174,1 Дж
+ 243174,1 Дж
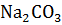 =
= 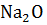 +
+ 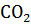 -324209,8 Дж,
-324209,8 Дж,
а на 5 кг карбоната натрия, в которых содержится 47,17 моль 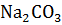 , будет затрачено теплоты 15292976 Дж, или 15292,98 кДж.
, будет затрачено теплоты 15292976 Дж, или 15292,98 кДж.
 2015-01-13
2015-01-13 15442
15442
