Определение катализа. Виды катализа. Хемосорбция и образование промежуточного активированного комплекса. Энергия активации каталитической реакции. Катализ и равновесие. Применение катализа.
Катализ – явление возбуждения химических реакций специальными веществами – катализаторами. Катализатор многократно вступает в промежуточное химическое взаимодействие с веществами, участвующими в реакции и восстанавливает свой состав после каждого цикла промежуточных взаимодействий.
Гомогенный катализ – реагирующие вещества и катализатор образуют одну фазу.
Гетерогенный катализ – вещества и катализатор находятся в разных фазах.
Микрогетерогенный катализ занимает промежуточное место между гомогенным и гетерогенным катализами. Катализатор – большие полимерные молекулы. Для взаимодействующих на них небольших молекул они подобны гетерогенным частицам, но образуют с реагентами одну фазу. В эту группу входят ферментативные реакции, в которых катализатор (фермент) – крупные белковые молекулы сложного состава и строения. Поэтому его называют и ферментативным катализом.
Химическое превращение протекает через образование активного комплекса, обладающего избыточной энергией. Ее достаточно для перестройки новых веществ – продуктов реакции. Изменение энергии системы при химическом взаимодействии по реакционному пути(1).
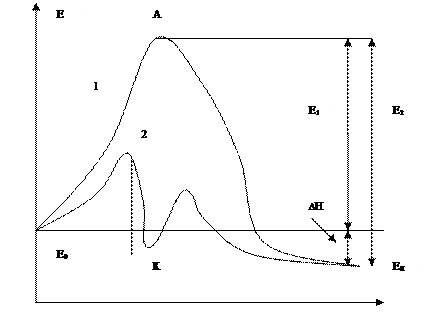
А – активированный комплекс
К –промежуточное соединение с катализатором
Е0, Ек – энергии исходных веществ и продуктов
Е1, Е2 – энергии активации превращения прямом и обратном направлениях
∆Н – изменение энергии в результате превращения (тепловой эффект).
Но не все молекулы обладают достаточной энергией для образования активного комплекса – только те, энергия которых превышает энергию активации Е1. Если необходимая энергия Е1 велика, то реакция практически не протекает.
Катализатор открывает новый реакционный путь, благодаря тому, что вступает в химическое взаимодействие с образованием активированного комплекса с меньшей энергией, чем требуется для образования активированного комплекса без катализатора. Промежуточное соединение, в которое входит катализатор, превращается далее в продукты через другой активированный комплекс, но тоже с меньшей энергией. После второго этапа реакции катализатор восстанавливает свой химический состав и его компоненты не входят в состав продуктов. И хотя реакционный путь удлиняется, становится стадийным, уменьшение энергии активированного комплекса приводит к увеличению скорости реакции (2).
Источник неизвестен
Особый интерес к катализу проявился в период развития промышленной химии, так как возможность ускорять химические реакции в нужном направлении без расхода энергии и по существу без расхода самого вещества катализатора придали катализу большую практическую значимость. С помощью катализа решаются задачи, стоящие перед технологией связанного азота, более 80% нефти перерабатывается с использованием каталитических процессов, невозможно осуществление большинства процессов органического синтеза.
Катализаторы – вещества, которые, многократно вступая в промежуточное взаимодействие с участниками реакции, изменяют ее механизм и увеличивают скорость реакции; при этом они восстанавливают свой химический состав после каждого цикла промежуточных воздействий.
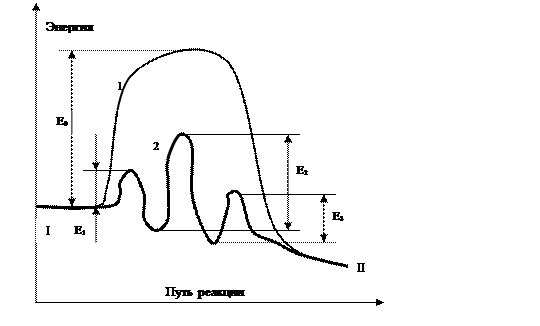
Влияние катализатора на механизм химической реакции можно пояснить на условном примере. Пусть протекает одностадийная реакция с энергией активации Е0:
А +В → R
Ход реакции на энергетической диаграмме каталитической и некаталитической реакций изображен кривой 1. В присутствии катализатора механизм реакции изменяется, она протекает через несколько последовательных стадий (кривая 2). Например, первой стадией может быть образование промежуточного активированного комплекса Акт:
А + Кт → АКт
Затем активированный комплекс реагирует со вторым реагентом с образованием комплекса катализатора и продукта:
АКт + В → RКт
Последней стадией является разложение комплекса RКт с образованием продукта К и высвобождением катализатора для нового каталитического цикла:
RКт → R +Кт
Каждая из этих последовательных стадий характеризуется своими значениями энергии активации Е1, Е2, Е3, но, как правило, высота каждого из этих потенциальных барьеров ниже энергии активации Е0. Таким образом, в присутствии катализатора реакция протекает по более энергетически выгодному пути, что позволяет проводить процесс с большей скоростью.
Исходное(I) и конечное (II) энергетические состояния реакционной системы в присутствии катализатора и без него остаются одинаковыми; следовательно: катализатор не может изменить состояние химического равновесия, которое не зависит от пути реакции.
Роль катализатора состоит лишь в изменении скорости достижения состояния равновесия. Катализатор может увеличить скорость только тех процессов, которые разрешены термодинамически, но не может инициировать термодинамически невозможные реакции.
Некоторые химические реакции без катализатора практически неосуществимы из-за слишком большой энергии активации. Казалось бы, что для преодоления высокого энергетического барьера можно повысить кинетическую энергию молекул, то есть увеличить температуру. Но для многих обратимых экзотермических реакций повышение температуры приводит к смещению равновесия в обратную сторону и делает реакцию неразрешенной термодинамически. В таких случаях применение катализаторов не только оправданно, но и необходимо. Катализатор снижает энергию активации и позволяет тем самым проводить ее при существенно более низких температурах.
Молекулы реагента адсорбируются на поверхности катализатора. Адсорбция представляет собой явление, связанное с уменьшением количества газа при соприкосновении газа (адсорбата) с твердым телом (адсорбентом), и заключается в некотором уплотнении газа на поверхности твердого тела. Различают физическую адсорбцию и хемосорбцию в зависимости от того, какова природа сил, вызывающих это концентрирование молекул адсорбата у поверхности твердого тела. Если эти силы имеют такую же природу, как и молекулярное воздействие в газах, жидкостях и твердых телах, то говорят о физической адсорбции. При хемосорбции проявляются силы взаимодействия химической природы – молекулы адсорбата теряют свою индивидуальность, образуя поверхностные соединения с адсорбентом.
При протекании каталитических процессов основная роль принадлежит хемосорбции, или активированной адсорбции, результатом которой является образование активированного комплекса адсорбции – неустойчивого промежуточного соединения между реагентом и катализатором. Стадия активированной адсорбции определяет специфичность действия катализаторов в отношении различных реакций. Если химическая связь реагента с адсорбентом слишком сильная, разрушение образования комплекса, ведущее к образованию продуктов, затрудняется. Если же связь адсорбента и адсорбата слишком слабая, близкая по своей природе к физической адсорбции, то в молекуле адсорбата не происходит разрыхления связей, приводящего к снижению энергии активации каталитического процесса по сравнению с некаталитическим.
Общая химическая технология, Кутепов А.М., Москва, Высшая школа, 1990, стр.206-207, 214, 205
 2015-01-21
2015-01-21 16365
16365
