Диссоциация комплексного соединения на ионы внешней сферы и комплексный ион, являющийся внутренней сферой (первичная диссоциация), протекает по типу сильного электролита:
Na2[Zn(OH)4] ® 2Na+ + [Zn(OH)4]2–
Диссоциация внутренней сферы комплексного соединения (вторичная диссоциация) протекает по типу слабого электролита, т.е. ступенчато, обратимо и не полностью. Диссоциация комплексных ионов, как и диссоциация всякого слабого электролита, характеризуется константой равновесия. В данном случае эта константа называется константой нестойкости комплекса. Чем больше константа нестойкости, тем более неустойчив данный комплекс. Равновесие каждой стадии диссоциации характеризуется своей константой нестойкости:
[Zn(OH)4]2– ⇆ [Zn(OH)3]– + OH– 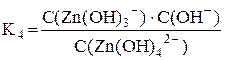
[Zn(OH)3]– ⇆ Zn(OH)2 + OH– 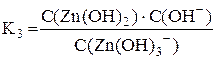
Zn(OH)2 ⇆ ZnOH+ + OH– 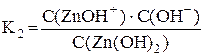
ZnOH+ ⇆ Zn2+ + OH– 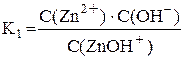
Суммарному процессу [Zn(OH)4]2– ⇆ Zn2+ + 4OH– соответствует общая константа нестойкости 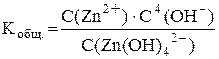 .
.
Очевидно, что Kобщ. = K1·K2·K3·K4.
Величина, обратная константе нестойкости, называется константой устойчивости комплекса: K уст. = 1/K нест.. Чем больше константа устойчивости, тем более устойчив комплекс.
|
|
|
Выше был показан пример диссоциации анионного комплекса. Диссоциацию катионного комплекса можно проиллюстрировать на примере сульфата тетраамминмеди (II):
первичная диссоциация
[Cu(NH3)4]SO4 ® [Cu(NH3)4]2+ + SO42–
вторичная диссоциация
[Cu(NH3)4]2+ ⇆ [Cu(NH3)3]2+ + NH3 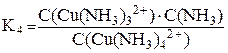
[Cu(NH3)3]2+ ⇆ [Cu(NH3)2]2+ + NH3 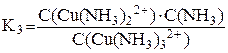
[Cu(NH3)2]2+ ⇆ [CuNH3]2+ + NH3 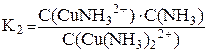
[CuNH3]2+ ⇆ Cu2+ + NH3 
Как видно из уравнений диссоциации комплексных соединений, число стадий вторичной диссоциации равно координационному числу комплексообразователя. Важным фактором, определяющим координационное число комплексообразователя, является соотношение размеров центрального иона и лигандов. Прослеживается также определённая зависимость координационного числа от заряда центрального иона (таблица 3.2).
Таблица. 3.2 – Координационные числа различных комплексообразователей
| Заряд центрального иона | +1 | +2 | +3 | +4 |
| Координационное число | 4(чаще всего) 6 (для Cr2+, Mn2+, Fe2+, Co2+, Ni2+) | 6 (чаще всего) 4 (для Au3+, Fe3+) |
 2015-02-04
2015-02-04 13591
13591
