Он включает в себя:
изучение технологии производств
оценку пожароопасных свойств веществ, обращающихся в технологических процессах
выявление возможных причин образования в производственных условиях горючей среды, источников зажигания и путей распространения пожара
разработку систем предотвращения возникновения пожара и противопожарной защиты
разработку организационно-технических мероприятий по обеспечению пожарной безопасности
После тщательного изучения технологии производств по технологическому
регламенту или проектным материалам определяются аппараты (оборудование), в которых содержатся легковоспламеняющиеся и горючие жидкости, горючие газы и твердые горючие вещества и материалы. Устанавливаются, какие именно вещества и в каком количестве участвуют в технологических процессах; при этом составляется полный перечень пожароопасных веществ и дается оценка их пожарной опасности. К пожароопасным относятся вещества и материалы, свойства которых каким-либо образом способствуют возникновению или развитию пожара. Свойства веществ, необходимые для анализа пожарной опасности, могут быть взяты в технологическом регламенте или пояснительной записке технологической части проекта, в нормативной и справочной литературе.
|
|
|
1 Особенности пожарно-технического обследования действующего производства.
Решение основной задачи службы пожарной охраны по предупреждению пожаров, созданию условий для их успешного тушения и обеспечению безопасности людей должно решаться путем дальнейшего совершенствования и повышения качества пожарно-технических обследований, являющихся основной формой профилактической работы на объектах. Задачей пожарно-технического обследования технологических процессов производств является определение соответствия технологии производств требованиям пожарной безопасности. Решение этой задачи на практике достигается путем:
*проверки правильности определения категории
помещений и зданий по взрывопожарной
и пожарной опасности
*проверки соответствия имеющейся защиты
требованиям пожарной безопасности
*улучшения деятельности ПТК и ДПД:
*повышения уровня обучения рабочих и служащих основам пожарной безопасности
Детальное пожарно-техническое обследование включает подготовительный, проверочный и заключительный этапы. Второй этап связан с осуществлением проверки технологического оборудования непосредственно в производственных цехах и на участках с целью выявления нарушений требований ГОСТов, норм и правил пожарной безопасности и определение соответствия принятых мер защиты требованиям пожарной безопасности Обследование технологии производства, как правило, оуществляется по технологической цепочке. При таком варианте проверку удается совместить с более углубленным изучением технологии производства, что повышает качество обследования и приводит к уменьшению затрат времени. Обследование, как правило, начинается с первичного внешнего осмотра производственного цеха, отделения, участка с целью оценки уровня общего состояния противопожарного режима (чистота и загазованность в цехе, степень загруженности, захламленность рабочих мест отходами производства и т.п.), технического состояния технологического оборудования (его исправность, герметичность, моральный и физический износ. Например, места неплотности, а иногда повреждений можно определить визуально по наличию подтеков, свежих пятен на технологическом оборудовании или его теплоизоляции, струек выходящего пара или газа, отложений солей и кокса, по наличию скоплений пыли у мест выхода из оборудования. Косвенными признаками нарушения герметичности оборудования или его неисправности может служить присутствие в воздухе большого количества газов, паров и пылей по общей загазованности или запыленности в производственном помещении. Обнаруженные при первичном осмотре недочеты фиксируются с целью детального изучения вызвавших их причин. Так, при обнаружении в цехе перегрузки, захламленности необходимо установить, имеется ли в цехе соответствующая инструкция о мерах пожарной безопасности и указано ли в ней предельно-допустимое количество одновременно находящихся у рабочих мест горючих веществ и материалов (готовой продукции и отходов). При обнаружении повышенной загазованности необходимо выяснить, предусмотрено ли в инструкции проведение систематического анализа воздуха на присутствие паров и газов, фиксируются ли данные таких анализов и каковы его результаты. Таким образом, первичный внешний осмотр позволяет не только сделать заключение об общем техническом состоянии производственного оборудования и противопожарного режима в цехе, но и наметить те узлы технологической цепочки или отдельные аппараты, на которых необходимо при дальнейшем обследовании сосредоточить основное внимание. Более углубленная проверка отдельного узла или аппарата состоит из всесторонней оценки возможности образования горючей среды. Выявляются причины ее образования внутри технологического аппарата и за его пределами при всех возможных режимах (нормальный режим работы, пуск и остановка, нарушение режима работы и повреждение). После установления причин повреждения технологического аппарата проверяется наличие мер защиты и их соответствие требованиям пожарной безопасности. При отсутствии достаточной защиты разрабатываются соответствующие предложения. По такой же схеме оценивается опасность в технологии производства специфических источников зажигания и возможных путей распространения огня в случае возникновения пожара. Важное значение при выявлении причин образования горючей среды в технологических процессах производств имеет проверка существующих мер защиты от повреждений технологического оборудования. В этой связи при обследовании необходимо прежде всего проверить соответствие режима работы аппаратов требованиям технологического регламента. Для этого выясняют, какие контрольно-измерительные приборы имеет данный аппарат, соответствует ли их тип и исполнение условиям пожарной безопасности, в каких точках измеряется температура и давление, где расположены датчики приборов, сравнивают показания приборов с технологическим регламентом, проверяют, имеется ли на приборах контроля опасных параметров технологического процесса четкие обозначения предельно допустимых величин (температуры, давления и т.п.)
|
|
|
Материальный и тепловой балансы процессов горения
|
|
|
Материальный баланс процесса горения выражает количественные соотношения между исходными веществами (топливо, воздух) и конечными продуктами (дымовые газы, зола, шлак), а тепловой баланс — равенство между приходом и расходом теплоты. Для твердого и жидкого топлива материальный и тепловой балансы составляют на 1 кг топлива, для газообразной фазы — на 1 м3 сухого газа при нормальных условиях (0,1013 МПа, О °С). Объемы воздуха и газообразных продуктов также выражают в метрах кубических, приведенных к нормальным условиям.
При сжигании твердого и жидкого топлива горючие вещества могут окисляться с образованием оксидов различной степени окисления. Стехиометрические уравнения реакций горения углерода, водорода и серы можно записать так:
| а) С+О2=СО2; б) С+(1/2)·О2=СО; в) S+О2=SО2; г) H2+(1/2)·О2=H2О; |
При расчете объемов воздуха и продуктов сгорания условно принимают, что все горючие вещества окисляются полностью с образованием только оксидов с наивысшей степенью окисления (реакции а, в, г).
Из уравнения (а) следует, что для полного окисления 1 кмоль углерода (12 кг) расходуется 1 кмоль, т. е. 22,4 м3, кислорода и образуется 1 кмоль (22,4 м3) оксида углерода. Соответственно для 1 кг углерода потребуется 22,4/12 = 1,866 м3 кислорода и образуется 1,866 м3 СО2. В 1 кг топлива содержится Сp/100 кг углерода. Для его горения необходимо 1,866·Сp/100 м3 кислорода и при сгорании образуется 1,866 Сp/100 м3CO2.
Аналогично из уравнений (в) и (г) на окисление горючей серы (μs = 32), содержащейся в 1 кг топлива, потребуется (22,4/32) Spл/100 м3 кислорода и образуется такой же объем SO2. А на окисление водорода (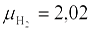 ), содержащегося в 1 кг топлива, потребуется 0,5·(22,4/2,02) Нp/100 м3 кислорода и образуется (22,4/2,02) Нp/100 м3водяного пара.
), содержащегося в 1 кг топлива, потребуется 0,5·(22,4/2,02) Нp/100 м3 кислорода и образуется (22,4/2,02) Нp/100 м3водяного пара.
Суммируя полученные выражения и учитывая кислород, находящийся в топливе (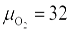 ), после несложных преобразований получим формулу для определения количества кислорода, теоретически необходимого для полного сжигания 1 кг твердого или жидкого топлива, м3/кг:
), после несложных преобразований получим формулу для определения количества кислорода, теоретически необходимого для полного сжигания 1 кг твердого или жидкого топлива, м3/кг:
|
|
|
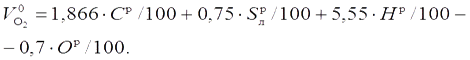
|
В воздухе содержится кислорода примерно 21 % по объему, поэтому количество воздуха, теоретически необходимое для полного сжигания 1 кг топлива V0, м3/кг, составляет:
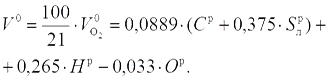
|
В процессе полного горения с теоретически необходимым количеством воздуха образуются газообразные продукты, которые состоят из CO2, SO2, N2 и H2O - оксиды углерода и серы являются сухими трехатомными газами. Их принято объединять и обозначать через RO2 = CO2 + SO2.
При горении твердых и жидких топлив теоретические объемы продуктов сгорания, м3/кг, вычисляют по уравнениям (15.1) с учетом содержания соответствующих компонентов в топливе и воздухе.
Объем трехатомных газов в соответствии с уравнениями (15.1, а и б)
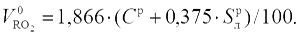
|
Теоретический объем азота равен объему азота, поступившему с воздухом 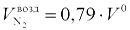 , и объему азота, выделяемого из топлива
, и объему азота, выделяемого из топлива 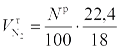 , т. е.
, т. е.
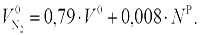
|
Теоретический объем водяного пара 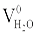 , м3/кг, складывается из объема, полученного при горении водорода, равного (22,4/2,02)·(Hp/100), объема, полученного при испарении влаги топлива, равного
, м3/кг, складывается из объема, полученного при горении водорода, равного (22,4/2,02)·(Hp/100), объема, полученного при испарении влаги топлива, равного 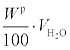 , и объема, вносимого с воздухом:
, и объема, вносимого с воздухом: 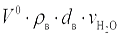 ,
, 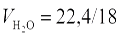 — удельный объем водяного пара, м3/кг; ρв = 1,293 кг/м3 — плотность воздуха, dв = 0,01 — содержание влаги в воздухе кг/кг. После преобразований получим:
— удельный объем водяного пара, м3/кг; ρв = 1,293 кг/м3 — плотность воздуха, dв = 0,01 — содержание влаги в воздухе кг/кг. После преобразований получим:
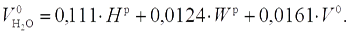
| (15.5) |
При паровом распылении мазута теоретический объем водяного пара увеличивают на объем водяного пара, подаваемого в форсунку: 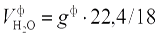 , где
, где 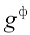 — удельный расход пара на распыление мазута, кг/кг.
— удельный расход пара на распыление мазута, кг/кг.
Суммарный теоретический объем продуктов сгорания, м3/кг:
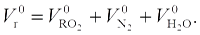
|
Действительный объем воздуха V может быть больше или меньше теоретически необходимого, подсчитанного по уравнениям горения. Отношение действительного объема воздуха V к теоретически необходимому V0 называется коэффициентом расхода воздуха α = V/V0. При α > 1 коэффициент расхода воздуха обычно называется коэффициентом избытка воздуха.
Для каждого вида топлива оптимальное значение коэффициента избытка воздуха в топке зависит от технических его характеристик, способа сжигания, конструкции топки, способа образования горючей смеси и др.
Действительный объем продуктов сгорания будет больше теоретического за счет азота, кислорода и водяного пара, который содержится в избыточном воздухе. Так как воздух не содержит трехатомных газов, то их объем не зависит от коэффициента избытка воздуха и остается постоянным, равным теоретическому, т. е. 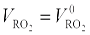 .
.
Объем двухатомных газов и водяного пара (м3/кг или м3/м3), определяют по формулам:
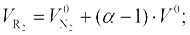
|
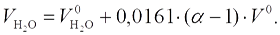
|
Суммарный объем продуктов сгорания при α > 1 (м3/кг или м3/м3) будет:
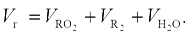
|
При сжигании твердых топлив концентрация золы в дымовых газах (г/м3) определяется по формуле
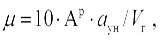
|
где 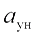 — доля золы топлива, уносимая газами (ее значение зависит от вида твердого топлива и способа его сжигания и принимается из технических характеристик топок).
— доля золы топлива, уносимая газами (ее значение зависит от вида твердого топлива и способа его сжигания и принимается из технических характеристик топок).
Объемные доли сухих трёхатомных газов и водяного пара, равные их парциальным давлениям при общем давлении 0,1 МПа, подсчитывают по формулам
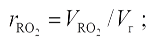 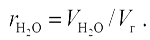
|
Все формулы для подсчета объемов применимы тогда, когда происходит полное сгорание топлива. Эти же формулы с достаточной для расчета точностью применимы и для неполного сгорания топлива, если не превышаются нормативные значения, приведенные в технических характеристиках топок.
Методы экспериментального определения показателей пожаро- и взрывоопасности веществ и материалов
61-64 (Тарасов)
61 Объем воздуха, необходимый для горения единицы массы сложного вещества. Избыток воздуха
Различают объём воздуха теоретически необходимый для сжигания вещества 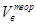 и действительно израсходованный объём воздуха
и действительно израсходованный объём воздуха 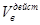 . При этом
. При этом
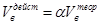 .
.
Множитель α называется коэффициентом избытка воздуха. Он показывает во сколько раз объём израсходованного воздуха больше теоретического объёма воздуха, необходимого для полного сгорания единицы количества вещества в стехиометрической смеси.
Разность между действительно необходимым и теоретическим объёмом воздуха называется избытком воздуха.
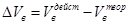 .
.
Из уравнений (1.1) и (1.2) следует, что
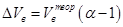 .
.
Для удобства расчётов все горючие вещества разделены на четыре группы в зависимости от состава и агрегатного состояния. В табл. 2-1 приведены формулы для расчёта теоретически необходимого объёма воздуха для сгорания всех групп веществ.
Табл. 2‑1 Расчётные формулы, для определения теоретического количества воздуха, необходимого для сгорания различных типов горючих веществ.
| Группа горючих веществ | Формула | Размерность |
| Индивидуальное горючее вещество в газообразном состоянии | 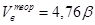
| м3/м3, кмоль/кмоль |
| Индивидуальное горючее вещество в конденсированном состоянии | 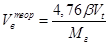
| м3/кг |
| Смесь газов | 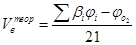
| м3/м3, кмоль/кмоль |
| Вещество сложного состава в конденсированном состоянии | 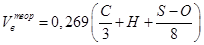
| м3/кг |
Мг – молярная масса горючего, Vt – молярный объём газа при заданных условиях (м3/кмоль), 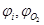 - процентное (по объёму) содержание i -того горючего газа и кислорода соответственно в горючей смеси. C,H,S,O - массовые проценты соответствующих элементов в составе горючего
- процентное (по объёму) содержание i -того горючего газа и кислорода соответственно в горючей смеси. C,H,S,O - массовые проценты соответствующих элементов в составе горючего
Для вычисления Vt воспользуемся объединённым газовым законом
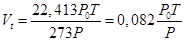 ,
,
где P0 – нормальное давление (101,3 кПа или 760 мм. рт. ст.), P, T -заданные давление и температура (в К). Молярный объём газа при нормальных условиях (P0=101,3 кПа или760 мм. рт. ст. T0 – 273К) равен 22,413 м3/кмоль.
Различают три вида топливных смесей, в зависимости от значения 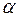 .
.
При 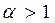 смеси называются бедными (окислителя в зону реакции подается больше, чем требуется для полного сгорания горючего). В продуктах сгорания таких смесей содержатся следующие элементы: Н2О, СО2, SO2, N2, О2.
смеси называются бедными (окислителя в зону реакции подается больше, чем требуется для полного сгорания горючего). В продуктах сгорания таких смесей содержатся следующие элементы: Н2О, СО2, SO2, N2, О2.
При 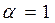 смеси называются стехиометрическими (окислителя в зону реакции подается столько, сколько требуется для полного сгорания горючего). В продуктах сгорания таких смесей содержатся следующие элементы: Н2О, СО2, SO2, N2.
смеси называются стехиометрическими (окислителя в зону реакции подается столько, сколько требуется для полного сгорания горючего). В продуктах сгорания таких смесей содержатся следующие элементы: Н2О, СО2, SO2, N2.
При 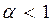 смеси называются богатыми (окислителя в зону реакции подается меньше, чем требуется для полного сгорания горючего). В продуктах сгорания таких смесей содержатся следующие элементы: Н2О, СО2, СО, С, N2.
смеси называются богатыми (окислителя в зону реакции подается меньше, чем требуется для полного сгорания горючего). В продуктах сгорания таких смесей содержатся следующие элементы: Н2О, СО2, СО, С, N2.
62 Объем и состав продуктов горения веществ м материалов.
При расчёте объёма продуктов горения пользуются формулами, приведёнными в табл. 2-2.
Табл. 2‑2 Расчётные формулы для определения объёмов продуктов горения
| Группа горючих веществ | Формула | Размерность |
| Индивидуальное горючее вещество в газообразном состоянии | 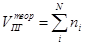
| м3/м3, кмоль/кмоль |
| Индивидуальное горючее вещество в конденсированном состоянии | 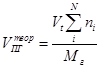
| м3/кг |
| Смесь газов | 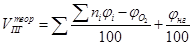
| м3/м3, кмоль/кмоль |
| Вещество сложного состава в конденсированном состоянии | 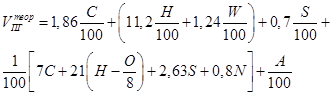
| м3/кг |
Здесь A – содержание негорючих компонентов (золы) в горючем, W – влажность горючего ni – коэффициенты при продуктах горения в уравнении реакции, φi – объёмная доля газообразного горючего в смеси. В формуле первое слагаемое даёт объём CO2, второе – H2O, третье - SO2, четвёртое – N2.
Действительный объём продуктов горения будет складываться из объёма продуктов сгорания и избыточного воздуха.
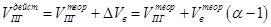
Процентный состав продуктов горения рассчитывается исходя из количества молей продуктов горения с учётом избыточного числа молей кислорода и азота. Процентное содержание продукта горения X составит
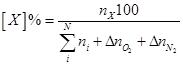 ,
,
где
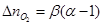
и
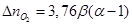
количества кислорода и азота, перешедшие из избыточного воздуха в продукты горения.
Если горючее имеет сложный состав и составить уравнение реакции невозможно, то состав продуктов горения может быть найден по формуле
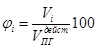 ,
,
где Vi – объём i-того продукта горения, Объёмы кислорода и азота воздуха в составе продуктов реакции составят
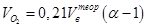
и
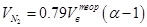
соответственно.
Если известно содержание кислорода в продуктах горения, то коэффициент избытка воздуха определяется по формуле
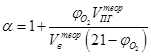 .
.
Если содержание кислорода в окислительной среде отличается от его содержания в воздухе, то формула принимает следующий вид
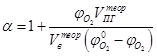 ,
,
где 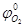 - содержание кислорода в окислительной среде, а
- содержание кислорода в окислительной среде, а 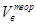 - теоретически необходимый объём окислительной среды.
- теоретически необходимый объём окислительной среды.
Перейти от объёма воздуха к его массе можно зная плотность воздуха
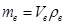 .
.
Считая воздух идеальным газом, и применяя уравнение Менделеева-Клапейрона для плотности воздуха, получим выражение
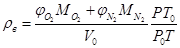 ,
,
где M, φ – молярная масса и объёмная доля соответствующего вещества, P0 = 101,3 кПа, T0 – 273,15 К – нормальные давление и температура, V0 =22,413 м3/кмоль – молярный объём газа при нормальных условиях. В составе воздуха по-прежнему учитываем только два компонента – кислород и азот. Подставляя числовые значения, получаем зависимость плотности воздуха от температуры и давления
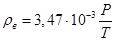 .
.
Для приведения объёма воздуха или продуктов горения к заданным условиям используется объединённый газовый закон
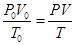 ,
,
где P,T,V – заданные давление, температура и искомый объём, P0 – 101325 Па, T0 = 273,15 К - нормальные давление и температура. V0 – объём газа при нормальных условиях.
63 Расчет количества продуктов горения при сгорании вещества индивидуального и вещества сложного состава
!!!Не нашел, спрошу у Адамяна!!!
64 Диффузионное и кинетическое горение.
Горение газопаровоздушной смеси подразделяется на диффузионное или кинетическое.
Кинетическое горение представляет собой горение предварительно перемешанных горючих газов и окислителя (кислорода воздуха). На пожарах этот вид горения встречается крайне редко. Однако он часто встречается в технологических процессах: в газовой сварке, резке и т.п.
При диффузионном горении окислитель поступает в зону горения извне. Поступает он, как правило, снизу пламени вследствие разрежения, которое создается у его основания. В верхней части пламени, выделяющееся в процессе горения тепло, создает давление. Основная реакция горения (окисления) происходит на границе пламени, поскольку истекающие с поверхности вещества газовые смеси препятствуют проникновению окислителя вглубь пламени (вытесняют воздух). Большая часть горючей смеси в центре пламени, не вступившая в реакцию окисления с кислородом, представляет собой продукты неполного горения (СО, СН4, углерод и пр.).
Диффузионное горение, в свою очередь, бывает ламинарным (спокойным) и турбулентным (неравномерным во времени и пространстве). Ламинарное горение характерно при равенстве скоростей истечения горючей смеси с поверхности материала и скорости распространения пламени по ней. Турбулентное горение наступает, когда скорость выхода горючей смеси значительно превышает скорость распространения пламени. В этом случае граница пламени становится неустойчивой вследствие большой диффузии воздуха в зону горения. Неустойчивость вначале возникает у вершины пламени, а затем перемещается к основанию. Такое горение встречается на пожарах при объемном его развитии (см. ниже).
Горение веществ и материалов возможно только при определенном количестве кислорода в воздухе. Содержание кислорода, при котором исключается возможность горения различных веществ и материалов, устанавливается опытным путем. Так, для картона и хлопка самозатухание наступает при 14% (об.) кислорода, а полиэфирной ваты — при 16% (об.) [62].
Исключение окислителя (кислорода воздуха) является одной из мер пожарной профилактики. Поэтому хранение легковоспламеняющихся и горючих жидкостей, карбида кальция, щелочных металлов, фосфора должно осуществляться в плотно закрытой таре.
65-68 (Убирайло)
65. Ламинарное и турбулентное горение. Критерий Рейнольдса.
Примером ламинарного горения может служить пламя свечи в неподвижном воздухе. При ламинарном горении слои газов текут параллельно, не завихряясь.
Турбулентное горение – вихревое движение газов, при котором интенсивно перемешиваются сгорающие газы, и фронт пламени размывается. Границей между этими видами служит критерий Рейнольдса, который характеризует соотношение между силами инерции и силами трения в потоке:
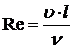 , (4.1)
, (4.1)
где: u скорость газового потока;
n кинетическая вязкость;
l – характерный линейный размер.
Число Рейнольдса, при котором происходит переход ламинарного пограничного слоя в турбулентный называется критическим Reкр, Reкр ~ 2320.
Турбулентность увеличивает скорость горения изза более интенсивной передачи тепла от продуктов горения в свежую смесь.
66. Нормальное, дефлаграционное и детонационное горение.
Нормальное горение – это горение, при котором распространение пламени происходит при отсутствии внешних возмущений (турбулентности или изменения давления газов). Оно зависит только от природы горючего вещества, т.е. теплового эффекта, коэффициентов теплопроводности и диффузии. В этом случае обычно скорость горения составляет 0,3-3,0 м/с. Нормальным горение названо потому, что вектор скорости его распространения перпендикулярен фронту пламени.
Дефлаграция - процесс распространения пламени по горючей газовой смеси, при котором самоускоряющаяся реакция горения распространяется вследствие разогрева путем теплопроводности от соседнего слоя продуктов реакции.Обычно скорости дефлаграционного горения дозвуковые, т.е. менее 333 м/с.
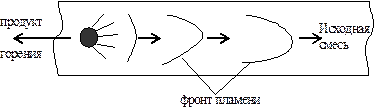
Детонационное горение. Если рассматривать сгорание горючей смеси послойно, то в результате термического расширения объема продуктов сгорания каждый раз впереди фронта пламени возникает волна сжатия. Каждая последующая волна, двига-ясь по более плотной среде, догоняет предыдущую и накладывается на нее. Постепенно эти волны соединяются в одну ударную волну (рис. 21).
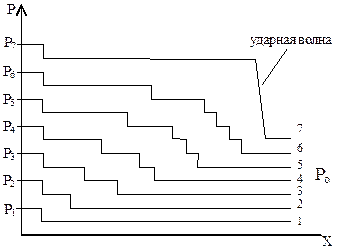
Рис. 21. Схема образования детонационной волны: Ро< Р1 < Р2 < Р3 < Р4 < Р5 < Р6 < Р7; 1-7 – нарастание давления в слоях с 1-го по 7-ой.
В ударной волне в результате адиабатического сжатия мгновенно увеличивается плотность газов и повышается температура до Т0 самовоспламенения. В результате происходит зажигание горючей смеси ударной волной и возникает детонация – распространение горения путем воспламенения ударной волной. Детонационная волна не гаснет, т.к. подпитывается ударными волнами от движущегося вслед за ней пламени. Детонация происходит с определенной для каждого состава смеси сверхзвуковой скоростью 1000-9000 м/с
67. Тепловое самовоспламенение.
Самовоспламенение – это явление резкого увеличения скорости экзотермических реакций, приводящее к самопроизвольному возникновению горения вещества в отсутствии источника зажигания.
При окислительной реакции, проходящей с полной отдачей образующегося тепла, горение не возникает. Горение возникает лишь в условиях резкого самоускорения химического процесса, связанного с накоплением либо тепла в системе (так называемое тепловое самовоспламенение), либо катализирующих промежуточных продуктов реакции (цепное самовоспламенение). Суть теории заключается в следующем. Рассмотрим поведение горючей смеси, заключенной в сосуд объемом V с постоянной температурой стенок Т0. В смеси протекает химическая реакция. Температура во всех точках сосуда одинакова и равна Т.
Исходя из физикохимических свойств газов, рассмотренных нами Ранее, скорость химической реакций υр подчиняется соотношению
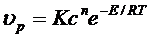 (6.1)
(6.1)
где: К – константа скорости реакций, зависящая от температуры;
с – концентрация реагирующих веществ;
n – порядок реакции;
Е – энергия активации реакции.
Скорость выделения тепла при реакции:
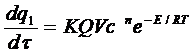 , (6.2)
, (6.2)
где: Q – тепловой эффект реакции;
V – объем сосуда;
τ – время.
Видно, что с повышением температуры скорость выделения тепла растет по экспоненте.
Выделившееся тепло расходуется на нагрев смеси и потери в окружающую среду за счет теплопроводности и излучения.
Количество тепла, отводимое от поверхности сосуда в единицу времени выражается линейною зависимостью:
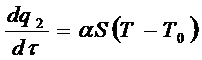 (6.3)
(6.3)
где: α – коэффициент теплоотдачи;
S – площадь поверхности стенок сосуда.
Тогда изменение подвода и отвода тепла в зависимости от температуры можно проиллюстрировать следующим образом (рис. 22):

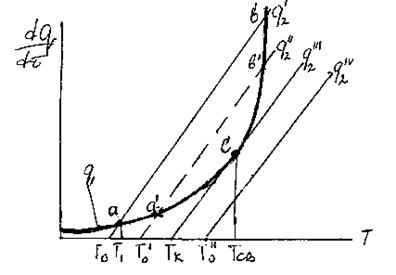
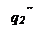



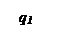

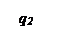
 Рис. 22. Соотношение тепловыделения и теплоотвода при тепловом взрыве.
Рис. 22. Соотношение тепловыделения и теплоотвода при тепловом взрыве.

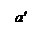





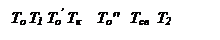
Три линии q 2 соответствуют трем значениям начальной температуры смеси То, Тк и То’.
Решающим условием возникновения процесса горения является превышение или равенство скорости выделения тепла реакции над скоростью отдачи тепла реагирующей системой в окружающую среду, например, стенкам реакционного сосуда.
При установившимся состоянии системы q 1= q 2 и температура в сосуде определяется как абсцисса точек пересечения линии q 1 с линиями q 2. Из рисунка видно, что линии прихода и отвода могут пересекаться в двух точках (точки a и b) либо в одной точке (точка с), либо не пересекаться.
Рассмотрим первый случай: нагрев смеси, имеющей начальную температуру То. При T=Tо скорость теплоотвода по условиям равна нулю и хотя q1 невелико, реагирующий газ начинает нагреваться. С повышением температуры и q1 и q2 возрастают. Пока температура газа лежит в интервале между Т0 и Т1 он продолжает нагреваться. При достижении Т1 величины q1 и q2 сравниваются и температура газа становится постоянной. Состояние системы в этой точке является устойчивым. Если в результате случайных причин температура газа превысит Т1 то теплоотвод скажется больше тепловыделения и система сама вернется в прежнее состояние. Если мы искусственно охладим газ, то он нагреется сам за счет реакции до T1. Режим медленной реакции, протеекающий с практически постоянной скоростью при Т=T1 сохраняется длительное время.
Вторая точка пересечения кривых (b) находится в области больших высоких температур, и режим тепловой реакции в этом случае будет неустойчивым. При отклонении от равновесного состояния в точке b система в него уже не возвращается.
Повышение начальной температуры стенок сосуда То до То' приводит к смещению вправо линии теплоотвода q2. Значение стационарной температуры Т1 будет при этом плавно расти (точка а'), и при температуре стенки Тк линии подвода и отвода тепла будут касаться одна другой в точке С, которая является граничной точкой существования стационарного режима, небольшое повышение температуры стенки выше Тк будет сопровождаться превышением теплоприхода над теплоотводом, что вызовет повышение температуры смеси и соответственно, резкое ускорение реакции.
Этот процесс перехода от медленно протекающей реакций к прогрессивно ускоряющемуся возгоранию смеси, является процессом самовоспламенения. А температура, откладываемая на оси абсцисс от точки С – температура самовоспламенения Тсв.
Минимальную температуру стенок сосуда Тк, при которой смещение достигнет равенства q1 = q2” – называют критической температурой воспламенения.
При повышении температуры сосуда до То" условия тепловыделения попрежнему описываются кривой q1, тогда как прямая теплоотвода q2''' пере местится вправо параллельно самой себе. При температуре То" сосуда теплоприход больше теплоотвода при любой температуре газа, и температура газа, а с нею и скорость реакции, будут прогрессивно расти.
Температура сосуда, для которой прямая теплоотвода q2” касательна к кривой тепловыделения, является предельной для перехода от режима медленной реакции к взрыву. При Tо>Tк скорость реакции и температура газа неограниченно увеличиваются и происходит тепловой взрыв. При Tо< Tк устанавливается стационарный режим, при котором скорость реакции мала.
Время, в течение которого в реагирующей системе достигается разогрев от Ткр до Тсв, называется периодом индукции самовоспламенения.
68. Зависимость между давлением и температурой самовоспламенения горючей смеси.
Теория теплового самовоспламенения хорошо объясняет зависимость между давлением и температурой самовоспламенения горючей смеси. Допустим, что сосуд, в который вводится смесь, имеет постоянную температуру То. При малых давлениях количество выделяющегося тепла не превышает количества отводимого тепла, и реакция протекает при постоянной температуре, близкой к температуре сосуда.
При увеличении давления и соответственно, массы вещества выделяется больше тепла, чем отводится, температура газов повышается и происходит их самовоспламенение. Наглядно зависимость теплоприхода и теплоотвода 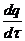 (где τ – время), от температуры при различных давлениях показана на рисунке 23:
(где τ – время), от температуры при различных давлениях показана на рисунке 23:
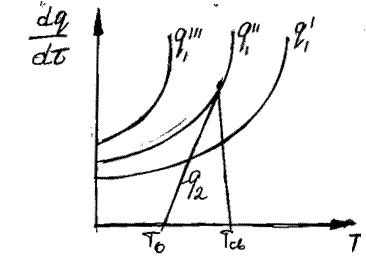
Рис. 23. Соотношение теплопри хода и теплоотвода при различном давлении газовой смеси: q1' < q1" < q1'''
Тут 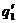
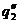
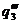 показывают тепловыделение при давлениях соответственно Р1<Р2<Р3 при одинаковом составе смеси. Количество отводимого от зоны горения тепла характеризуется прямой q 2. Критические условия самовоспламенения реализуются при давлении Р2 (кривая
показывают тепловыделение при давлениях соответственно Р1<Р2<Р3 при одинаковом составе смеси. Количество отводимого от зоны горения тепла характеризуется прямой q 2. Критические условия самовоспламенения реализуются при давлении Р2 (кривая 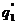 ).
).
Условия самовоспламенения предельного состава горючей смеси показана на кривых 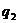 и
и 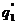 . В общем, условие теплового самовоспламенения сводится к тому, что начальный саморазогрев горючей смеси в результате реакции окисления должен превысить некоторое критическое значение
. В общем, условие теплового самовоспламенения сводится к тому, что начальный саморазогрев горючей смеси в результате реакции окисления должен превысить некоторое критическое значение 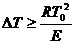 , называемое характеристическим интервалом температуры
, называемое характеристическим интервалом температуры
69-72 (Химиченко)
69,70-это продолжение 69 кто то ошибся в мою пользу .!..
Зависимость температуры самовоспламенения от концентрации паров горючей жидкости в паровоздушной смеси.
На практике достаточно часто встречаются случаи самопроизвольного возникновения горения горючих веществ, когда горение в горючей системе возникает без внешнего источника зажигания. Такое возникновение горения в газо- и паровоздушных смесях называют самовоспламенением. Как правило, самовоспламенение в горючих газо- и паровоздушных смесях происходит при повышенных температурах, т.е. при условиях, способствующих химической реакции между горючим и окислителем. Рассмотрим кратко причины, приводящие к возникновению горения в такой системе. Представим себе газо- или паровоздушную смесь, находящуюся при повышенной температуре, при которой в ней с заметной скоростью происходит экзотермическая реакция. Тепло, выделяющееся в горючей системе в результате химической реакции, будет приводить к ее саморазогреву. Чем выше температура горючей смеси, тем выше скорость химической реакции, соответственно выше скорость тепловыделения в системе. Скорость тепловыделения (q+) пропорциональна скорости химической реакции (Wх.р.)
q+ = Q × Wх.р., (5.1) где Q – тепловой эффект химической реакции. С повышением температуры (Т) в реагирующей системе увеличивается и скорость оттока тепла (q-) в окружающую среду, которая пропорциональна разнице температур q- = a V S (Т-То)
где a – коэффициент теплоотдачи; S – площадь поверхности теплообмена; V – объем горючей системы; То – температура окружающей среды (начальная температура горючей системы). Таким образом, повышение температуры реагирующей системы в результате ее саморазогрева приводит к увеличению скорости одновременно двух процессов: тепловыделения в системе и теплоотвода из нее. В зависимости от температуры среды, окружающей систему. Повышение температуры в системе может приводить либо к выравниванию q+ и q- и наступлению теплового равновесия, либо все большему расхождению между величинами q+ и q-, прогрессирующему саморазогреву и следующему за этим тепловому взрыву. Тепловой взрыв в горючих газо- и паровоздушных смесях приводит к самовоспламенению. Минимальная температура горючей смеси, при которой прогрессирующий саморазогрев системы приводит к тепловому взрыву и появлению пламени, называется температурой самовоспламенения. На практике за температуру самовоспламенения принимают минимальную температуру стенок сосуда, при которой горючая смесь, помещенная в этот сосуд, воспламеняется. Температура самовоспламенения является одним из важнейших показателей пожарной опасности. Теория теплового взрыва, развитая академиком Н.Н. Семеновым достаточно подробно рассмотрена в учебном пособии «Теория горения и взрыва». Там же с позиций этой теории анализируется влияние различных факторов на температуру самовоспламенения.
Температуру самовоспламенения предельных углеводородов, одноатомных спиртов и ароматических соединений можно приближенно рассчитать по средней длине углеродной цепи молекулы (см. «Методические указания к решению задач по ТгиВ»). Для экспериментального определения температуры самовоспламенения горючих жидкостей используют реакционный сосуд, представляющий собой коническую колбу из кварцевого стекла, помещенную в нагревательную печь. В нагретый сосуд с помощью микропипетки вводят определенное количество испытуемой жидкости. Жидкость в сосуде испаряется и, смешиваясь с воздухом, образует горючую паровоздушную смесь. В зависимости от температуры стенок сосуда горючая смесь либо самовоспламеняется, либо нет. Изменяя температуру стенок сосуда, находят минимальную температуру, при которой паровоздушная смесь воспламеняется, и это значение принимают за температуру самовоспламенения. Поскольку температура самовоспламенения зависит от концентрации горючего вещества в паровоздушной смеси, опыты повторяют с другим количеством испытуемой жидкости до тех пор, пока не будет установлено минимальное значение температуры самовоспламенения для данного вещества. За температуру самовоспламенения вещества принимают ее минимальное значение, полученное по результатам экспериментального исследования зависимости температуры самовоспламенения от объема вводимой жидкости (или концентрации горючего вещества). Вид такой зависимости показан на рис. 5.1. Как правило, минимальное значение температуры самовоспламенения имеют стехиометрические смеси, или смеси, близкие к стехиометрическим. Поэтому если известна химическая формула исследуемого вещества, то по уравнению горения предварительно рассчитывают стехиометрическую концентрацию вещества и определяют, какое количество жидкости необходимо ввести, чтобы в сосуде установилась концентрация, близкая к стехиометрической.
TCB
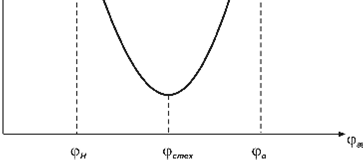
Зависимость температуры самовоспламенения от концентрации
горючего вещества в паровоздушной смеси.
Формулу, связывающую концентрацию горючего (jг) в паровоздушной
смеси в сосуде объемом V с, нагретом до температуры Тс с объемом вводимой
жидкости V ж, можно получить из следующих простых соображений:
Vж=
где V ж и rж – объем и плотность вводимой горючей жидкости;
М – масса одного моля горючего вещества (жидкости);
V пар– объем паров горючей жидкости в сосуде;
V т– объем одного моля газа (пара) при условиях опыта (Тс, Ратм);
V о = 22,4 л/моль – объем одного моля газа (пара) при нормальных
условиях (То = 273 К, Ро = 101,3 кПа).
Из этого следует, что
Формула (5.4) позволяет рассчитывать объем горючей жидкости,
который необходимо ввести в сосуд для того, чтобы в нем образовалась
паровоздушная смесь с концентрацией горючего jг. И, наоборот, по
известному объему вводимой горючей жидкости определять концентрацию
горючего в паровоздушной смеси, образующейся в реакционном сосуде.
71. Зажигание жидкостей с высокой температурой воспламенения.
Температурные пределы воспламенения. Температура жидкости, при которой над поверхностью создается концентрация насыщенного пара, равная нижнему концентрационному пределу воспламенения, называется нижним
температурным пределом воспламенения (НТПВ).
Температура жидкости, при которой над поверхностью создается концентрация насыщенного пара, равная верхнему концентрационному пределу воспламенения, называется верхним температурным пределом воспламенения (ВТПВ).
Например, для ацетона температурные пределы равны: НТПВ 253 К, ВТПВ 279 К. При этих температурах образуются концентрации паров соответственно 2,6 и 12,6% (об.).
Температурные пределы воспламенения используют для оценки пожарной опасности жидкостей, при расчете безопасных режимов работы закрытых технологических аппаратов и складских емкостей с жидкостями и летучими твердыми веществами. Для пожаробезопасносги технологического процесса, связанного с применением жидкостей, последний ведут при температурах ниже НТПВ на 10 К или выше ВТПВ на 15 К. Для многих жидкостей температурные пределы определены и результаты сведены в справочные таблицы.
Температурные пределы воспламенения определяют на стандартном приборе (ТП), разработанном во ВНИИПО. Сущность метода заключается в определении минимальной и максимальной температур жидкости, при которых образуются концентрации насыщенных паров, равные нижнему и верхнему концентрационным пределам. Прибор ТП (рис. 34) состоит из стеклянного цилиндрического реакционного сосуда 1 диаметром 65±2 мм, высотой 125±5 мм, электродов спирального 5 и искрового 4 зажигания, двухзонной термопары 2 в стеклянном чехле (расстояние между зонами измерения 60±2 мм), термостата или криостата (на рис. 14 не показан), в который помещают сосуд. Они обеспечивают поддержание постоянной температуры в реакционном сосуде в течение 15 мин с точностью ± 1 °С. Количество наливаемой жидкости составляет 10% от всей емкости реакционного сосуда.
Температура вспышки. Температура вспышки — самая низкая температура (в условиях специальных испытаний) вещества, при которой над поверхностью его образуются пары и газы, способные вспыхивать в воздухе от источника зажигания для последующего горения.
Жидкости, способные гореть, делятся на легко воспламеняющиеся ЛВЖ и горючие ГЖ- ЛВЖ —это жидкости, имеющие температуру вспышки не выше 61 °С (в закрытом тигле) или 65°С (в открытом тигле). ГЖ — это жидкости, имеющие температуру вспышки выше 61 °С (в закрытом тигле) или 66 °С (в открытом тигле).
В соответствии с международными рекомендациями легко воспламеняющиеся жидкости делятся па три разряда:
I разряд — особо опасные ЛВЖ, к ним относятся легко воспламеняющиеся жидкости с температурой вспышки от —18°С и ниже в закрытом тигле или от —13°С и ниже в открытом тигле;
II разряд—постоянно опасные ЛВЖ, к ним относятся легко воспламеняющиеся жидкости с температурой вспышки выше —18 °С до 23 °С в закрытом тигле или выше —13 до 27 °С в открытом тигле;
III разряд — ЛВЖ опасные при повышенной температуре воздуха, к ним относятся легко воспламеняющиеся жидкости с температурой вспышки выше 23 до 61 °С в закрытом тигле или выше 27 до 66 °С в открытом
тигле.
В зависимости от температуры вспышки устанавливают безопасные способы хранения, транспортирования и применения жидкостей для различных целей. Tемпература вспышки повышается с увеличением молекулярной массы, температуры кипения и плотности. Эти закономерности в гомологическом ряду говорят о том, что температура
вспышки связана с физическими свойствами веществ и сама является физическим параметром.
Можно разбавить горючую жидкость до такой степени, что получившаяся смесь не будет иметь температуру вспышки.
Горение хорошо растворимых в воде жидкостей прекращается, когда концентрация горючей жидкости достигает 10—25 %.
С повышением температуры жидкости скорость испарения увеличивается и при определенной температуре достигает такой величины, что раз подожженная смесь продолжает гореть после удаления источника воспламенения. Такую температуру жидкости принято называть температурой воспламенения. Для ЛВЖ она отличается на 1—5°С от температуры вспышки, а для ГЖ — 30-35 °С. При температуре воспламенения жидкостей устанавливается постоянный (стационарный) процесс горения.
71. Движение летучих продуктов сквозь поверхностные слои при зажигании твердых веществ/
Образование газообразных (летучих) горючих веществ из твердых материалов почти всегда связано с термическим разложением или пиролизом молекул полимера при повышенных температурах вблизи поверхности горения. Предшествует этому процессу плавление или нет - зависит от природы материала (рис. 1.3 и табл. 1.3). Как правило, летучие вещества представляют собой сложную смесь продуктов пиролиза. В нее входят простые молекулы (например, водород и этилен) и вещества с относительно большой относительной молекулярной массой, которые становятся летучими только при температурах, существующих в зоне их образования, и при условии, что их тепловая энергия достаточно велика для преодоления сил сцепления с поверхностью сконденсировавшегося горючего. При пламенном горении большинство этих веществ будет вступать в реакцию в зоне пламени, но в других условиях (например, в случае пиролиза без горения под действием внешнего источника тепла или для некоторых материалов при тлеющем горении, разд. 8.2, при смешивании с холодным воздухом будет происходить конденсация высококипящих жидких продуктов и смол, в результате которой образуется аэрозольный дым.
Зажигание можно определить как такой процесс, с помощью которого возникает быстрая экзотермическая реакция, распространяющаяся на материал, вызывая в нем изменения, приводящие к резкому повышению температуры относительно температуры окружающей среды. Так, зажигание стехиометрической пропано-воздушной смеси вызывает реакцию окисления. Эта реакция в виде пламени распространяется по смеси, превращая углеводородные соединения в диоксид углерода и водяной пар характерной температуры, заключенной в диапазоне 2000— 2500 К (гл. 1). Удобно различать два характерных вида возникновения процесса горения, а именно 1)вынужденное зажигание, при котором воспламенение возникает в горючей паровоздушной смеси с помощью некоторого источника зажигания, такого, как электрическая искра или постороннее пламя 2) самовоспламенение, при котором воспламенение развивается спонтанно внутри горючей смеси. Для достижения пламенного горения жидких и твердых горючих веществ необходим внешний подвод тепла. Исключение составляет вынужденное зажигание воспламеняющихся жидкостей, температура воспламенения которых ниже температуры окружающей среды (см. разд. 6.2.1). В гл. 8 будет отдельно рассмотрен процесс самовоспламенения в массе твердых тел.
Для жилых домов и общественных зданий температуры внутри помещений достигают 800-900 °С. На рис. 4.3 показано изменение температур внутри помещения при горении твердых веществ. С увеличением количества горючего вещества (горючей загрузки) на единицу площади пола повышается максимальная температура и увеличивается продолжительность пожара (рис. 4.4). Продолжительность и температура пожара зависят также от вида горючего материала.
Основными показателями горючих свойств твердых веществ и материалов являются группа горючести и температура воспламенения. Горючесть — это способность вещества (материала, смеси, конструкции) к самостоятельному горению. По горючести твердые вещества и материалы разделяются на негорючие, трудногорючие и горючие.
Температура самовоспламенения характеризует возможность начала пламенного горения вещества при контакте его с кислородом воздуха. Температура самовоспламенения горючей системы обычно относится к горючему веществу, входящему в нее. Она не является постоянной для одного и того же горючего вещества и изменяется в зависимости от его концентрации, давления, размеров, формы и материала сосудов и от других факторов. С увеличением объема и повышением давления смеси температура самовоспламенения снижается. Так, например, у бензина температура самовоспламенения составляет 480 °С при абсолютном давлении 0,1 МН/м2 (1 кгс/см2) и 310 °С при 1 МН/м2 (10 кгс/см2), а у керосина соответственно 460 и 250°С.
Основными показателями горючих свойств твердых веществ и материалов являются группа горючести и температура воспламенения. Горючесть — Зто способность вещества (материала, смеси, конструкции) к самостоятельному горению. По горючести твердые вещества и материалы разделяют на негорючие, трудногорючие и горючие.
Известно, что возникновение горения возможно в том случае, если температура пламени источника воспламенения превышает температуру вспышки или воспламенения горючего вещества или же передает (путем теплопроводности, конвекции или лучеиспускания) горючей массе количество тепловой энергии, достаточное для нагревания последней до температуры самовоспламенения. Дуга, возникающая между токопроводящими проводниками (например, кабеля), по своим физическим свойствам сходна с электросварочной дугой между медными электродами, температура столба которой в воздухе даже при токе, равном 3 А, превышает 4000 К (л.з.). Однако дуга, горящая между жилами кабеля, имеет еще более высокую температуру, так как, во-первых, величина дугового к.з. в цеховых сетях достигает нескольких тысяч ампер, а, во-вторых, горение протекает в более активной среде, образующейся в результате разложения органической изоляции жил кабеля под действием высокой температуры дуги. В начальный период возникновения открытой дуги нагревание оказывающегося вблизи нее горючего материала происходит за счет передачи теплоты дуги излучением. Интенсивность излучения, как известно, пропорциональна температуре в четвертой степени, а количество тепловой энергии, воспринимаемой облучаемым телом, определяется поглощающей способностью последнего, его массой, теплоемкостью, расстоянием от источника и временем облучения.
В процессе горения дуги происходит бурное испарение металла жил проводников и образование газообразных продуктов вследствие разложения материала изоляционных и защитных покрытий. Смесь газов и частиц расплавленного металла благодаря давлению газа выбрасывается в окружающую атмосферу и, сгорая в ней, образует пламя высокой температуры, что, в свою очередь, ускоряет процесс воспламенения горючего вещества. Таким образом, период воспламенения горючего материала электрической дугой тока к.з. характеризуется многообразием термических процессов, на протекание которых оказывает влияние множество факторов и аналитический учет которых представляет чрезвычайно большие трудности.
Условия возгорания определяются так называемым треугольником горения (рис. 1), две вершины которого определяют наличие горючего вещества и окислителя - кислорода воздуха, а третья вершина задает условие воспламенения - нагрев материала до температуры самовоспламенения.
Если тепловой поток является непрерывным, то условие, соответствующее температуре воспламенения, можно охарактеризовать минимумом температуры поверхности, при которой исходящий с этой поверхности поток летучих продуктов будет достаточным для поддержания пламенного горения на поверхности. Можно выделить ряд факторов, которые, по-видимому, существенны для достижения температуры воспламенения. К этим факторам можно отнести эффекты, связанные с химической реакцией, проходящей на поверхности и под ней. Сюда же можно отнести и движение летучих продуктов сквозь поверхностные слои. Однако, если принять что материал твердого вещества является полностью инертным, задачу можно упростить, сведя ее к задаче о теплопередаче к поверхности. Эти вопросы были подвергнуты анализу в обзоре, где были рассмотрены различные решения уравнения одномерной задачи теплопроводности, причем граничные условия этой краевой задачи подбирались для рассмотрения ряда практических конфигураций, включая как неограниченную пластину, так и полубесконечное одномерное твердое тело (эти граничные условия были рассмотрены в разд. 2.2.2). Во всех случаях принималось, что твердое тело является непрозрачным и инертным, а также обладает однородными тепловыми характеристиками, которые не зависят от температуры. Химическим разложением и связанными с этим энергетическими изменениями в твердом теле пренебрегают, хотя сомнительность таких пренебрежений очевидна. Тем не менее влияние указанных факторов можно отнести ко вторичным эффектам, что позволяет выделить подлежащие изучению основные моменты, влияющие на процесс зажигания твердых веществ. Большинство теоретических и экспериментальных исследований концентрировались на зажигании, индуцированном лучистым тепловым потоком. Первоначальным стимулом для проведения этих исследований было понимание того, что уровни теплового излучения при ядерном взрыве могут оказаться достаточными для зажигания горючих материалов на больших расстояниях от центра взрыва. Однако совсем недавно стало очевидным, что излучение играет фундаментальную роль в развитии и распространении пожара во многих случаях, таких как пожары открытых очагов (штабелей, сложенных из бревен или брусьев и т. д.) и помещений (гл. 9). Сохраняется сильный интерес к зажиганию излучением, хотя нельзя при этом игнорировать и зажигание при конвективном теплообмене. В следующих разделах будут рассмотрены соответствующие решения уравнения одномерной задачи теплопроводности
Пребывание в горящем здании людей, не принимающих непосредственного участия в тушении пожара и лишенных средств защиты, становится опасным уже при температуре окружающей среды выше 60° С, при задымленности, затрудняющей ориентирование в пространстве, снижении содержания кислорода в помещении до 17— 18%. Наступление такого момента (критическая фаза развития пожара) зависит от многих факторов, но главным образом от характера горючего материала и его количества. При горении волокнистых веществ, горючих жидкостей сильная задымленность в производственном помещении и нагрев воздуха выше 60° С могут произойти за несколько минут (от 1—2 до 5—6 мин). За это время все работающие в самой большой смене должны иметь возможность эвакуироваться из здания.
Температура воспламенения — это минимальная температура вещества или материала, при которой они выделяют горючие пары и газы с такой скоростью, что при наличии источника зажигания возникает устойчивое горение. После удаления этого источника вещество продолжает гореть. Таким образом, температура воспламенения характеризует способность вещества к самостоятельному устойчивому горению.
Многообразие горючих веществ, с которыми мы сталкиваемся, очень велико. Оно включает в себя простейшие газообразные углеводороды и твердые вещества с большой относительной молекулярной массой и сложной химической структурой. Некоторые из горючих веществ имеют естественное происхождение, например целлюлоза, тогда как другие являются искусственными, например полиэтилен и полиуретан (табл. 1.1 и 1.2). Все эти вещества, реагируя с кислородом воздуха, образуя продукты горения и высвобождая тепло, горят при определенных условиях. Так, поток или струя газообразного углеводорода может загореться в воздухе с образованием пламени, являющимся видимой частью области, внутри которой протекает процесс окисления. Образование пламени связано с газообразным состоянием вещества, поэтому горение жидких и твердых веществ, сопровождающееся возникновением пламени, предполагает их переход в газообразную фазу. В случае горения жидкостей этот процесс обычно заключается в простом кипении с испарением у поверхности, однако при горении почти всех твердых веществ образование продуктов с достаточно низкой относительной молекулярной массой способных улетучиваться с поверхности материала и попадать в область пламени, происходит путем химического разложения или пиролиза. Поскольку для пиролиза требуется значительно больше энергии, чем для простого испарения, температура горящих твердых материалов, как правило, высока и обычно составляет 400°С. Исключением из этого правила являются те твердые вещества, которые при нагреве сублимируют, т. е. непосредственно переходят из твердой фазы в газообразную без химических превращений. Примером такого вещества является гек-саметилентетрамин, или метенамин, который в виде шариков используется в качестве источника зажигания при испытаниях материалов на воспламеняемость [12]. Согласно оценкам [424], он сублимирует при температуре 285-295°С.
В течение первой фазы происходит преимущественно линейное распространение огня вдоль горючего вещества или материала. Горение сопровождается обильным дымовыделением, что затрудняет определение места очага пожара. Среднеобъемная температура повышается в помещении до 200°С (темп увеличения средне-обьемной температуры в помещении 15°С в 1 мин). Приток воздуха в помещение увеличивается. Поэтому очень важно в это время обеспечить изоляцию помещения от наружного воздуха (не рекомендуется открывать или вскрывать окна и двери в горящее помещение. В некоторых случаях, при достаточном обеспечении герметичности помещения, наступает самозатухание пожара) и вызвать пожарные под-
Горючесть — способность вещества к горению. Горючесть зависит от параметров состояния системы вещество — окислительная среда (температуры, давления, объема). Горючесть пылей зависит от степени их измельчения. По горючести пыли (как и другие вещества) разделяют на три группы негорючие, трудногорючие и горючие. Группу горючести используют при отнесении производства к той или иной кат
 2015-02-18
2015-02-18 2992
2992