Состояние данной массы газа полностью определено, если известны его давление, температура и объем. Эти величины называют параметрами состояния газа. Уравнение, связывающее параметры состояния, называют уравнением состояния.
Для произвольной массы газа состояние газа описывается уравнением Менделеева—Клапейрона: pV = mRT/M, где р — давление, V — объем, m — масса, М — молярная масса, R — универсальная газовая постоянная. Физический смысл универсальной газовой постоянной в том, что она показывает, какую работу совершает один моль идеального газа при изобарном расширении при нагревании на 1 К (R = 8,31 Дж/моль • К)). Уравнение Менделеева—Клапейрона показывает, что возможно одновременное изменение трех параметров, характеризующих состояние идеального газа. Однако многие процессы в газах, происходящие в природе и осуществляемые в технике, можно рассматривать приближенно как процессы, в которых изменяются лишь два параметра. Особую роль в физике и технике играют три процесса: изотермический, изохорный и изобарный.
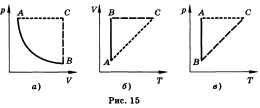
Изопроцессом называют процесс, происходящий с данной массой газа при одном постоянном параметре — температуре, давлении или объеме. Из уравнения состояния как частные случаи получаются законы для изопроцессов.
Изотермическим называют процесс, протекающий при постоянной температуре. Т = const. Он описывается законом Бойля—Мариотта: pV = const.
Изохорным называют процесс, протекающий при постоянном объеме. Для него справедлив закон Шарля: V = const, p/T = const.
Изобарным называют процесс, протекающий при постоянном давлении. Уравнение этого процесса имеет вид V/T = const прир = const и называется законом Гей-Люссака. Все процессы можно изобразить графически (рис. 15).
Реальные газы удовлетворяют уравнению состояния идеального газа при не слишком высоких давлениях (пока собственный объем молекул пренебрежительно мал по сравнению с объемом сосуда,
в котором находится газ) и при не слишком низких температурах (пока потенциальной энергией межмолекулярного взаимодействия можно пренебречь по сравнению с кинетической энергией теплового движения молекул), т. е. для реального газа это уравнение и его следствия являются хорошим приближением.
|
|
|
Вопрос 2. Основы СТО. Инерциальные системы отсчёта. Принцип относительности. Постулаты специальной теории относительности.
Специальная теория относительности Эйнштейна – это новое учение о пространстве и времени, пришедшее на смену старым (классическим) представлениям.
В основе теории относительности лежат два постулата.
Первый постулат (принцип относительности): все процессы природы протекают одинаково во всех инерциальных системах отсчёта.
|
|
|
Это означает, что во всех инерциальных системах физические законы имеют одинаковую форму.
Инерциальными называются такие системы отсчёта, относительно которых тело при отсутствии внешних воздействий движется прямолинейно и равномерно.
Системы отсчёта, связанные с Землёй, обычно считаются инерциальными.
Второй постулат (постулат постоянства скорости света): скорость света в вакууме одинакова для всех инерциальных систем отсчёта. Она не зависит ни от скорости источника, ни от скорости приёмника светового сигнала.
Скорость света: c = 3 ٠ 108 м/с. Скорость света в вакууме является максимально возможной скоростью передачи взаимодействий в природе.
Согласно теории относительности размеры предметов и интервалы времени не являются абсолютными, а зависят от скорости движения. При скоростях близких к скорости света масса тела увеличивается с увеличением скорости, линейные размеры тела уменьшаются, а интервал времени между событиями увеличивается. Явление замедления времени было обнаружено экспериментально в ядерной физике при наблюдении распада элементарных частиц.
Но при скоростях движения, много меньших скорости света, эти эффекты незаметны, и справедливы классические представления о пространстве и времени и законы механики Ньютона.
Билет №19
- Модель строения жидкостей. Насыщенные и ненасыщенные пары; зависимость давления насыщенного пара от температуры; кипение. Влажность воздуха; точка росы, гигрометр, психрометр.
- Дисперсия и поглощение света; спектроскоп и спектрограф.
- Задача на применение закона Джоуля-Ленца.
Вопрос 1. Испарение жидкостей. Насыщенный и ненасыщенный пары. Влажность воздуха и её измерение.
В жидкостях все молекулы двигаются с разными скоростями: у некоторых молекул кинетическая энергия больше, у других – меньше.
Испарением называется такой процесс, при котором с поверхности жидкости вылетают молекулы, кинетическая энергия которых превышает потенциальную энергию взаимодействия других молекул.
Испарение происходит при любой температуре и сопровождается охлаждением жидкости.
Чтобы увеличить интенсивность испарения необходимо нагреть жидкость, увеличить площадь открытой поверхности, обдувать потоками воздуха. Пример: высыхание белья.
Конденсация – это процесс обратный испарению, т.е. переход вещества из газообразного состояния в жидкое. Пример: капли воды на холодном стекле.
Если сосуд с жидкостью закрыть, то над поверхностью жидкости будет увеличиваться концентрация молекул испаряющегося вещества. Через некоторое время наступит динамическое равновесие: число молекул, покидающих жидкость, станет равно числу молекул, вернувшихся в жидкость за то же время.
Пар, находящийся в динамическом равновесии со своей жидкостью, называется насыщенным паром.
Давление насыщенного пара вычисляется по формуле: 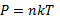 , где P - давление, измеряется в Паскалях (Па), n - концентрация, измеряется в 1/м3, k – постоянная Больцмана, T – абсолютная температура.
, где P - давление, измеряется в Паскалях (Па), n - концентрация, измеряется в 1/м3, k – постоянная Больцмана, T – абсолютная температура.
Пар, находящийся при давлении ниже насыщенного, называется ненасыщенным.
Влажность воздуха – это содержание водяного пара в воздухе.
Относительной влажностью воздуха называют отношение парциального давления водяного пара, содержащегося в воздухе при данной температуре, к давлению насыщенного пара при той же температуре.
Обозначается φ, выражается в %. Формула: 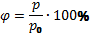 ,
,
где 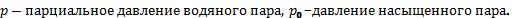
Влажность измеряют с помощью специальных приборов. Один из них – психрометр, состоящий из двух термометров (сухого и влажного). По разности температур этих термометров с помощью специальных таблиц можно определить влажность воздуха.
Испарение — парообразование, происходящее при любой температуре со свободной поверхности жидкости. Неравномерное распределение кинетической энергии молекул при тепловом движении приводит к тому, что при любой температуре кинетическая энергия некоторых молекул жидкости или твердого тела может превышать потенциальную энергию их связи с другими молекулами. Большей кинетической энергией обладают молекулы, имеющие большую скорость, а температура тела зависит от скорости движения его молекул, следовательно, испарение сопровождается охлаждением жидкости. Скорость испарения зависит: от площади открытой поверхности, температуры, концентрации молекул вблизи жидкости. Конденсация — процесс перехода вещества из газообразного состояния в жидкое.Испарение жидкости в закрытом сосуде при неизменной температуре приводит к постепенному увеличению концентрации молекул испаряющегося вещества в газообразном состоянии. Через некоторое время после начала испарения концентрация вещества в газообразном состоянии достигнет такого значения, при котором число молекул, возвращающихся в жидкость, становится равным числу молекул, покидающих жидкость за то же время. Устанавливается динамическое равновесие между процессами испарения и конденсации вещества. Вещество в газообразном состоянии, находящееся в динамическом равновесии с жидкостью, называют насыщенным паром. (Паром называют совокупность молекул, покинувших жидкость в процессе испарения.) Пар, находящийся при давлении ниже насыщенного, называют ненасыщенным.Вследствие постоянного испарения воды с поверхностей водоемов, почвы и растительного покрова, а также дыхания человека и животных в атмосфере всегда содержится водяной пар. Поэтому атмосферное давление представляет собой сумму давления сухого воздуха и находящегося в нем водяного пара. Давление водяного пара будет максимальным при насыщении воздуха паром. Насыщенный пар в отличие от ненасыщенного не подчиняется законам идеального газа. Так, давление насыщенного пара не зависит от объема, но зависит от температуры. Эта зависимость не может быть выражена простой формулой, поэтому на основе экспериментального изучения зависимости давления насыщенного пара от температуры составлены таблицы, по которым можно определить его давление при различных температурах.
Давление водяного пара, находящегося в воздухе при данной температуре, называют абсолютной влажностью, или упругостью водяного пара. Поскольку давление пара пропорционально концентрации молекул, можно определить абсолютную влажность как плотность водяного пара, находящегося в воздухе при данной температуре, выраженную в килограммах на метр кубический (р).
Большинство явлений, наблюдаемых в природе, например быстрота испарения, высыхание различных веществ, увядание растений, зависит не от количества водяного пара в воздухе, а от того, насколько это количество близко к насыщению, т. е. от относительной влажности, которая характеризует степень насыщения воздуха водяным паром. При низкой температуре и высокой влажности повышается теплопередача и человек подвергается переохлаждению. При высоких температурах и влажности теплопередача, наоборот, резко сокращается, что ведет к перегреванию организма. Наиболее благоприятной для человека в средних климатических широтах является относительная влажность 40—60%. Относительной влажностью называют отношение плотности водяного пара (или давления), находящегося в воздухе при данной температуре, к плотности (или давлению) водяного пара при той же температуре, выраженное в процентах, т. е.
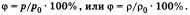 Относительная влажность колеблется в широких пределах. Причем суточный ход относительной влажности обратен суточному ходу температуры. Днем, с возрастанием температуры и, следовательно, с ростом давления насыщения, относительная влажность убывает, а ночью возрастает. Одно и то же количество водяного пара может либо насыщать, либо не насыщать воздух. Понижая температуру воздуха, можно довести находящийся в нем пар до насыщения. Точкой росы называют температуру, при которой пар, находящийся в воздухе, становится насыщенным. При достижении точки росы в воздухе или на предметах, с которыми он соприкасается, начинается конденсация водяного пара. Для определения влажности воздуха используются приборы, которые называются гигрометрами и психрометрами.
Относительная влажность колеблется в широких пределах. Причем суточный ход относительной влажности обратен суточному ходу температуры. Днем, с возрастанием температуры и, следовательно, с ростом давления насыщения, относительная влажность убывает, а ночью возрастает. Одно и то же количество водяного пара может либо насыщать, либо не насыщать воздух. Понижая температуру воздуха, можно довести находящийся в нем пар до насыщения. Точкой росы называют температуру, при которой пар, находящийся в воздухе, становится насыщенным. При достижении точки росы в воздухе или на предметах, с которыми он соприкасается, начинается конденсация водяного пара. Для определения влажности воздуха используются приборы, которые называются гигрометрами и психрометрами.
|
|
|
|
|
|
Вопрос 2. Дисперсия света. Спектр. Спектроскоп.
Дисперсия света – это зависимость показателя преломления света от его длины волны или частоты.
Дисперсию света можно наблюдать при прохождении света через стеклянную призму: белый свет разлагается на составные части (кр., оранж., жел., зел., гол., син., фиол.).
Наиболее сильно преломляются фиолетовые лучи, меньше других – красные.
Луч красного цвета преломляется меньше всего из-за того, что имеет в веществе наибольшую скорость (и наименьшую частоту), а луч фиолетового цвета преломляется больше, т.к. скорость фиолетового света наименьшая (а частота наибольшая).
Дисперсию изучал Ньютон. Саму радужную полоску Ньютон назвал спектром.
Прибор для наблюдения спектров называется спектроскоп. Его основные части – стеклянная призма и две трубки. В одну трубку свет попадает через отверстие, проходит через призму, через линзы. Через вторую трубку (зрительную) можно наблюдать спектр.
Билет №20
- Модель строения твердых тел. Изменения агрегатных состояний вещества. Кристаллические тела: анизотропия кристаллов; плотная упаковка; пространственная решетка; монокристаллы и поликристаллы; полиморфизм, аморфные тела.
- Опыт Резерфорда; ядерная модель атома; квантовые постулаты Бора; лазеры.
- Экспериментальное задание: «Измерение мощности лампочки накаливания».
Вопрос 1. Агрегатные состояния вещества и фазовые переходы, их объяснения на основе молекулярно-кинетической теории.
В зависимости от условий одно и то же вещество может находиться в различных состояниях: в твёрдом, жидком или газообразном (например, вода, лёд, водяной пар).
Эти состояния называются агрегатными.
Молекулы одного и того же вещества в твёрдом, жидком или газообразном состоянии одни и те же, ничем не отличаются друг от друга, меняется их взаимное расположение.
В газах расстояние между атомами и молекулами в среднем во много раз больше размеров самих молекул. Молекулы с огромными скоростями движутся в пространстве.
Молекулы жидкости расположены почти вплотную друг к другу. Они колеблются около положений равновесия, сталкиваясь с соседними молекулами. Иногда молекулы совершают перескоки с места на место.
У твёрдых тел атомы и молекулы занимают строго упорядоченные положения в пространстве, образуя кристаллическую решётку.
Переход вещёства из одного состояния в другое называют фазовым переходом.
Изменение внутренней энергии может приводить к изменению агрегатного состояния.
При нагревании молекулы начинают больше колебаться и двигаться, и расстояние между ними увеличивается.
Переход вещества при определённой температуре из твёрдого состояния в жидкое называется плавлением.
Переход вещества из жидкого состояния в твёрдое называется отвердеванием или кристаллизацией.
Переход вещества из жидкого состояния в газообразное называется испарением.
Переход вещества из газообразного состояния в жидкое называется конденсацией.
Вопрос 2. Опыты Резерфорда по рассеянию α-частиц. Ядерная модель атома. Квантовые постулаты Бора.
Первая модель атома была предложена английским физиком Томсоном. По Томсону, атом представляет собой положительно заряженный шар, внутри которого находятся отрицательно заряженные электроны.
Модель атома Томсона была неверной, что подтвердилось в опытах английского физика Резерфорда в 1906 г.
В этих опытах узкий пучок α-частиц, испускаемых радиоактивным веществом, направлялся на тонкую золотую фольгу. За фольгой помещался экран, способный светиться под ударами быстрых частиц.
Было обнаружено, что большинство α-частиц отклоняется от прямолинейного распространения после прохождения фольги, т.е. рассеиваются. А некоторые α-частицы вообще отбрасываются назад.
Рассеяние α-частиц Резерфорд объяснил тем, что положительный заряд не распределён равномерно по шару, как предполагал Томсон, а сосредоточен в центральной части атома – атомном ядре. При прохождении около ядра α-частица, имеющая положительный заряд, отталкивается от него, а при попадании в ядро – отбрасывается назад.
Резерфорд предположил, что атом устроен подобно планетарной системе.
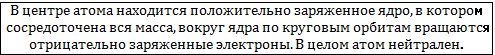
Но Резерфорд не мог объяснить устойчивости (почему электроны не излучают волны и не падают к положительно заряженному ядру).
Новые представления об особых свойствах атома сформулировал датский физик Бор в двух постулатах.
1-й постулат. Атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует соя энергия; в стационарном состоянии атом не излучает.
2-й постулат. При переходе атома из одного стационарного состояния в другое испускается или поглощается квант электромагнитного излучения.
Энергия излученного фотона равна разности энергий атома в двух состояниях:
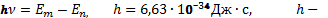 постоянная Планка.
постоянная Планка.
Билет №21
- Термодинамический подход к изучению физических явлений. Внутренняя энергия и способы ее изменения. Первый закон термодинамики. Применение первого закона термодинамики к изотермическому, изохорному и адиабатному процессам.
- Модели строения атомного ядра; ядерные силы; нуклонная модель ядра; энергия связи ядра; ядерные реакции.
- Задача на применение закона Кулона.
Вопрос 1. Внутренняя энергия и способы её изменения. Первый закон термодинамики.
Любое тело обладает внутренней энергией.
Внутренняя энергия макроскопического тела равна сумме кинетических энергий движения молекул, из которых состоит тело, и потенциальных энергий взаимодействия молекул.
Внутренняя энергия обозначается буквой U, измеряется в Джоулях.
Внутренняя энергия идеального одноатомного газа прямо пропорциональна его абсолютной температуре. 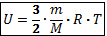 , где
, где 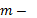 масса газа,
масса газа, 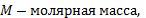
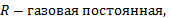
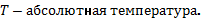
Существует два способа изменения внутренней энергии: теплопередача (теплообмен) и совершение работы.
Теплопередача – это изменение внутренней энергии без совершения работы: энергия передаётся от более нагретых тел к менее нагретым.
Мерой переданной энергии при теплопередаче является количество теплоты Q.
При совершении работы газ расширяется или сжимается. Работа газа при изобарном расширении от объёма 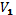 до объёма
до объёма 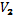 вычисляется по формуле:
вычисляется по формуле: 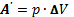 , где
, где 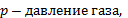
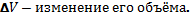
I закон термодинамики: изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе. 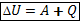
Вопрос 2. Цепная реакция деления ядер урана и условия её протекания. Термоядерная реакция.
Ядерными реакциями называют изменения атомных ядер, вызванные их взаимодействием с элементарными частицами или друг с другом.
В 1938 г. немецкие физики Ган и Штрасман открыли деление урана под действием нейтронов: ядро урана делится на два близких по массе ядра.
У этой реакции есть две важные особенности, которые сделали возможным её практическое применение:
1. При делении каждого ядра урана выделяется значительная энергия.
2. Деление каждого ядра сопровождается вылетом 2-3 нейтронов, которые могут вызвать деление следующих ядер, т.е. сделать реакцию цепной.
Для осуществления цепной реакции используют ядра изотопа урана с массовым числом 235, т.е.. Именно они хорошо делятся под действием как быстрых, так и медленных нейтронов.
Ядра изотопа урана с массовым числом 238 () используют для получения плутония, который также используют для цепной ядерной реакции.
Для осуществления цепной реакции необходимо, чтобы среднее число освобождённых в данной массе нейтронов не уменьшалось с течением времени. Управляемую цепную реакцию проводят в ядерных реакторах, которые конструируют так, чтобы коэффициент размножения k нейтронов был равен единице. Если число нейтронов будет увеличиваться с течением времени и k >1, то произойдет взрыв.
Термоядерные реакции – это реакции слияния лёгких ядер при очень высокой температуре (примерно 107 Кельвинов и выше).
Легче всего осуществить реакцию синтеза между тяжелыми изотопами водорода - дейтерием и тритием. При этом в результате получается ядро гелия 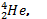 нейтрон и выделяется огромная энергия.
нейтрон и выделяется огромная энергия.
Работы над созданием управляемой термоядерной реакцией ещё ведутся.
Пока удалось осуществить неуправляемую термоядерную реакцию в водородной бомбе.
Билет №22
- Тепловые машины: основные части и принципы действия тепловых машин; коэффициент полезного действия тепловой машины и пути его повышения; проблемы энергетики и охрана окружающей среды.
- Радиоактивность; радиоактивные излучения; закон радиоактивного распада.
- Экспериментальное задание: «Исследование треков заряженных частиц по готовым фотографиям»
Вопрос 1. Принципы действия тепловых двигателей. КПД тепловых двигателей. Роль тепловых двигателей в народном хозяйстве и проблемы их использования.
Тепловые двигатели – это устройства, превращающие внутреннюю энергию топлива в механическую.
Для того чтобы двигатель совершал работу, необходима разность давлений по обе стороны поршня двигателя или лопастей турбины. Во всех тепловых двигателях эта разность давлений достигается за счёт повышения температуры рабочего тела на сотни и тысячи градусов по сравнению с температурой окружающей среды. Такое повышение температуры происходит при сгорании топлива.
Рабочим телом у всех двигателей является газ, который совершает работу при расширении.
Температуру Т1 называют температурой нагревателя.
По мере совершения работы газ теряет энергию и охлаждается до температуры Т2, которую называют температурой холодильника.
Холодильником обычно является окружающая среда.
Коэффициентом полезного действия теплового (КПД) называют отношение работы А′, совершаемой двигателем, к количеству теплоты 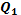 , полученному от нагревателя:
, полученному от нагревателя:
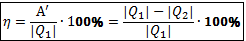
Максимально возможный КПД вычисляют по формуле Карно: 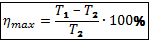
Наибольшее значение имеет использование тепловых двигателей на тепловых электростанциях, где они приводят в движение роторы генераторов.
Также на всех основных видах транспорта преимущественно используются тепловые двигатели.
Все тепловые двигатели при работе выделяют большое количество теплоты и выбрасывают в атмосферу вредные для растений и животных химические соединения. Это ставит серьёзные проблемы охраны окружающей среды.
Вопрос 2. Состав ядра атома. Радиоактивность. Виды радиоактивных излучений и их свойства.
Ядро атома любого химического элемента состоит из положительно заряженных протонов (р) и не имеющих заряда нейтронов (n).
Протоны и нейтроны являются двумя зарядовыми состояниями частицы, называемой нуклон.
Количество протонов и нейтронов можно определить по таблице Менделеева.
Порядковый номер – это количество протонов. Чтобы узнать количество нейтронов, нужно из атомной массы вычесть количество протонов.
Например, в ядре атома кислорода8 протонов и 8 нейтронов.
Радиоактивность – это способность атомов одних химических элементов самопроизвольно (спонтанно) превращаться в атомы других химических элементов. При этом излучаются α-, β- и γ-лучи и выделяется энергия.
Явление радиоактивности было открыто опытным путём французским учёным Беккерелем в 1896 г. Он заметил, что соли урана засвечивают завёрнутую во много слоёв фотобумагу невидимым проникающим излучением.
В дальнейшем радиоактивность изучали Мария и Пьер Кюри и Резерфорд.
Было открыто три составляющих радиоактивного излучения: α-, β- и γ-лучи.
α-лучи – это поток ядер атомов гелия – тяжелые положительно заряженные частицы. Они слабо отклоняются электрическими и магнитными полями и обладают наименьшей проникающей способностью (слой бумаги толщиной около 0,1 мм для них уже непрозрачен).
β-лучи – это поток электронов (лёгкие, отрицательно заряженные), движущимися со скоростями, близкими к скорости света. Они сильно отклоняются электрическими и магнитными полями и гораздо меньше поглощаются веществом (их задерживает алюминиевая пластинка толщиной в несколько миллиметров).
γ-лучи – это электромагнитные волны с очень большой частотой (более 1020 Гц). Их скорость около 300 000 км/с. Они не отклоняются электрическими и магнитными полями и обладают самой большой проникающей способностью. Интенсивность поглощения γ-лучи увеличивается с увеличением атомного номера вещества-поглотителя. При прохождении γ-лучей через слой свинца толщиной в 1 см их интенсивность убывает лишь вдвое.
γ-лучи представляют для человека наибольшую опасность.
Билет №23
- Необратимость тепловых процессов; второй закон термодинамики и его статическое истолкование.
- Ядерные реакции: законы сохранения при ядерных реакциях. Цепные ядерные реакции; ядерная энергетика; термоядерные реакции.
- Экспериментальное задание: «Измерение сопротивления участка цепи с использованием амперметра и вольтметра»
Вопрос 1.
Вопрос 2.
Билет №24
- Элементарный электрический заряд; два вида электрических зарядов, закон сохранения электрического заряда; закон Кулона, электрическое поле: напряженность электрического поля, линии напряженности электрического поля; принцип суперпозиции электрических полей.
- Магнитные свойства вещества. Гипотеза Ампера. Магнитная проницаемость. Температура Кюри.
- Задачи на применение закона сохранения импульса.
Вопрос 1. Электрическое поле. Напряжённость электрического поля. Электризация тел. Электрический заряд. Закон сохранения электрического заряда. Взаимодействие заряженных тел. Закон Кулона.
Электрическое поле – это особая форма материи, существующая независимо от нас и от наших знаний о нём. Оно обладает следующими свойствами: возникает вокруг заряженных тел и действует на заряженные тела с некоторой силой.
Поле одного заряда действует на другой заряд и наоборот.
Характеристикой электрического поля является напряженность.
Напряженность поля – это векторная величина, равная отношению силы, с которой поле действует на точечный заряд, к величине этого заряда. 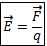 .
.
Напряженность обозначается  .
.
Направление вектора 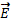 совпадает с направлением силы, действующей на положительный заряд, и противоположно направлению силы, действующей на отрицательный заряд.
совпадает с направлением силы, действующей на положительный заряд, и противоположно направлению силы, действующей на отрицательный заряд.
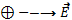
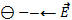
Если в данной точке пространства несколько заряженных частиц создают электрические поля, то результирующая напряженность поля в этой точке находится по правилу сложения векторов: 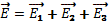 +…
+…
Все тела в обычном состоянии не имеют заряда.
Чтобы тело получило заряд, его нужно наэлектризовать: отделить отрицательный заряд от связанного с ним положительного. Простейший способ электризации – трение.
При электризации в теле возникает избыток или недостаток электронов.
Взаимодействие между заряженными частицами называется электромагнитным.
Электрический заряд – это физическая величина, определяющая интенсивность электромагнитного взаимодействия.
Электрический заряд обозначается буквой q, измеряется в Кулонах (Кл).
Существует минимальный заряд, называемый элементарным, которым обладают все заряженные элементарные частицы.
Элементарный заряд равен 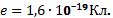
Полный заряд замкнутой системы остаётся постоянным:
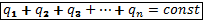 закон сохранения заряда.
закон сохранения заряда.
Существуют заряды двух знаков: положительный и отрицательный. Одноимённые заряды отталкиваются, разноимённые – притягиваются.
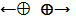 ⊕⟶ ⟵
⊕⟶ ⟵ 
Закон Кулона. Сила взаимодействия двух точечных неподвижных заряженных тел в вакууме прямо пропорциональна произведению модулей этих зарядов и обратно пропорциональна квадрату расстояния между ними.
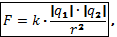 где
где 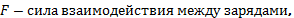
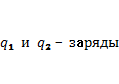
Вопрос 2.
Билет №25
- Работа сил электрического поля. Потенциальность электрического поля. Потенциал и разность потенциалов; эквипотенциальные поверхности. Связь между напряженностью и разновидность потенциалов.
- Наша Галактика. Другие галактики. Пространственные масштабы наблюдаемой Вселенной.Применимость законов физики для объяснения природы космических объектов.
- Экспериментальное задание: «Оценка массы воздуха в классной комнате».
Вопрос 1.
Вопрос 2.
Билет №26
- Радиоактивность. Радиоактивные излучения и методы их регистрации. Биологическое действие ионизирующих излучений.
- Явление электромагнитной индукции. Индукционный ток. Опыты Фарадея. Переменный ток.
- Задача на применение закона всемирного тяготения.
 2015-04-08
2015-04-08 10469
10469
