Уравнения химических реакций, в которых указаны изменения энтальпии (тепловые эффекты реакций), называются термохимическими. При написании термохимических уравнений указывается и агрегатное состояние вещества. Твердое вещество, жидкость и газ обозначаются соответствующими символами – (тв), (ж) и (г), т.к. величина изменения энтальпии зависит от агрегатного состояния реагирующих веществ и продуктов реакции.
Тепловые эффекты реакций выражают в килоджоулях (кДж) для одного моля реагента или (реже) для моля продукта реакции.
Например, термохимическое уравнение реакции синтеза аммиака:
N2(г) + 3Н2 (г) = 2NH3 (г), ΔН= – 92,4 кДж
показывает, что при взаимодействии 1 моль азота N2 и 3 моль водорода Н2 образуется 2 моль аммиака NH3 и выделяется количество теплоты, равное 92,4 кДж (∆ Н = – 92, 4 кДж).
Представленное ниже термохимическое уравнение реакции сгорания водорода в кислороде:
H2(г) + 1/2 O2(г) = H2О(ж) + 286 кДж
показывает, что на 1 моль сгоревшего водорода или на 1 моль образовавшейся воды выделяется 286 кДж теплоты (Q = 286 кДж, ΔН = -286 кДж). Эта реакция является экзотермической и характеризуется значительным тепловым эффектом. Недаром водород считается эффективным топливом будущего.
|
|
|
Термохимические уравнения подчиняются закону Лавуазье-Лапласа: тепловой эффект прямой реакции равен по абсолютной величине, но противоположен по знаку тепловому эффекту обратной реакции.
Это означает, что при образовании любого соединения выделяется (поглощается) столько же энергии, сколько поглощается (выделяется) при его распаде на исходные вещества. Например, реакция горения водорода в кислороде является экзотермической:
H2(г) + 1/2 O2(г) = H2О(ж) + 286 кДж (ΔH1 = – 286 кДж).
В то же время, реакция разложения воды электрическим током требует затрат энергии и является эндотермической:
H2О(ж) 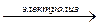 = H2(г) + 1/2 O2(г) - 286 кДж (ΔH1 = + 286 кДж).
= H2(г) + 1/2 O2(г) - 286 кДж (ΔH1 = + 286 кДж).
Закон Лавуазье–Лапласа является следствием закона сохранения энергии.
 2015-04-12
2015-04-12 5019
5019
