Органическая химия.
Тема: ««Кислородсодержащие органические соединения»
Лекция 9. Карбоновые кислоты. Сложные эфиры.
План.
1.Карбоксильная группа. Классификация карбоновых кислот. Гомологический ряд предельных одноосновных кислот: номенклатура, изомерия.
2. Строение карбоксильной группы
3. Физические и химические свойства уксусной кислоты.
4. Получение, применение уксусной кислоты.
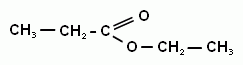
5. Строение и номенклатура сложных эфиров.
6. Свойства сложных эфиров, применение.
7. Получение, нахождение в природе, применение.
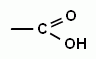
1. Карбоновые кислоты – это карбонильные соединения, в которых карбонил (группа =С=О) и гидроксогруппа (группа –ОН) находятся у одного атома углерода.
 -СООН
-СООН
Такую функциональную группу, характерную для карбоновых кислот называют карбоксильной. В зависимости от числа карбоксильных групп различают одноосновные и многоосновные кислоты. По характеру радикала кислоты делят на предельные, непредельные и ароматические кислоты. В природе кислоты могут встречаться в свободном состоянии, но чаще встречаются в виде сложных эфиров и других производных.
|
|
|
Гомологический ряд предельных одноосновных кислот. Атом углерода, который входит в карбоксильную группу является первичным, т.е. эта функциональная группа может находиться только на конце углеродной цепи. Точнее в начале, потому что эта функциональная группа является самой главной, она всегда обозначается в названии суффиксом «-овая кислота». Кроме систематических названий для первых представителей ряда широко используют тривиальные названия. Для предельных одноосновныхкислот нет изомерии положения функциональной группы, есть только изомерия углеродного скелета и межклассовая изомерия со сложными эфирами.
Например:
Метановая (муравьиная) кислота; Этановая (уксусная кислота; Пропановая (пропионовая) кислота;
Бутановая (масляная) кислота …
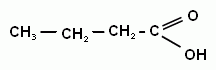
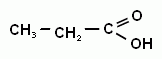
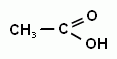
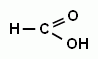
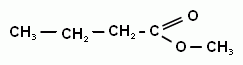
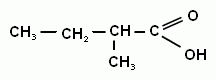
2.
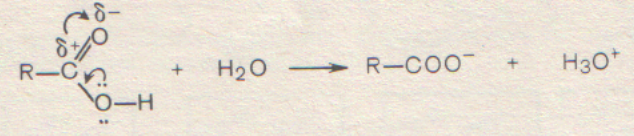 Особенности строения карбоксильной группы. Взаимное влияние карбонильной и гидроксогруппы приводит к изменению их свойств. Влияние гидроксогруппы на карбонильную группу проявляется в том, что в результате смещения избытка электронной плотности кислорода к карбонильному атому углерода уменьшается положительный заряд на нем. Значит, реакции присоединения по двойной связи, которые характерны для карбонильных соединений, для карбоновых кислот становятся нехарактерны. Влияние карбонильной группы на гидроксогруппу проявляется в том, что благодаря положительному заряду карбонильного атома углерода происходит смещение электронной плотности от группы ОН. Это способствует увеличению полярности связи между водородом и кислородом и уменьшает полярность связи углерода с кислородом. Т.е. облегчается разрыв связи О-Н карбоксильной группы. А значит появляются кислотные свойства, которые связаны с возможностью отщепления протона. Остается возможен и разрыв связи между углеродом и гидроксогруппой. Но эта реакция проходит хуже, чем у спиртов.
Особенности строения карбоксильной группы. Взаимное влияние карбонильной и гидроксогруппы приводит к изменению их свойств. Влияние гидроксогруппы на карбонильную группу проявляется в том, что в результате смещения избытка электронной плотности кислорода к карбонильному атому углерода уменьшается положительный заряд на нем. Значит, реакции присоединения по двойной связи, которые характерны для карбонильных соединений, для карбоновых кислот становятся нехарактерны. Влияние карбонильной группы на гидроксогруппу проявляется в том, что благодаря положительному заряду карбонильного атома углерода происходит смещение электронной плотности от группы ОН. Это способствует увеличению полярности связи между водородом и кислородом и уменьшает полярность связи углерода с кислородом. Т.е. облегчается разрыв связи О-Н карбоксильной группы. А значит появляются кислотные свойства, которые связаны с возможностью отщепления протона. Остается возможен и разрыв связи между углеродом и гидроксогруппой. Но эта реакция проходит хуже, чем у спиртов.
|
|
|
3. Физический свойства предельных одноосновных кислот. Между молекулами кислоты, благодаря группам ОН, образуются многочисленные водородные связи. Поэтому газов среди кислот нет, у них аномально высокие температуры кипения. У муравьиной кислоты около 100 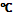 , а для уксусной – 118
, а для уксусной – 118 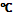 Температура кристаллизации уксусной кислоты 16,6
Температура кристаллизации уксусной кислоты 16,6 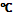 , поэтому абсолютную уксусную кислоту называют ледяной. Низшие представители предельных одноосновных кислот являются подвижными жидкостями, неограниченно растворимы в воде, имеют характерный запах. Начиная с валериановой (пентановой) кислоты, это маслянистые жидкости, ограничено растворимые, имеют характерный запах. Высшие кислоты (больше 6 углеродов в цепи) – твердые вещества, практически нерастворимые, запаха не имеют.
, поэтому абсолютную уксусную кислоту называют ледяной. Низшие представители предельных одноосновных кислот являются подвижными жидкостями, неограниченно растворимы в воде, имеют характерный запах. Начиная с валериановой (пентановой) кислоты, это маслянистые жидкости, ограничено растворимые, имеют характерный запах. Высшие кислоты (больше 6 углеродов в цепи) – твердые вещества, практически нерастворимые, запаха не имеют.
 Химические свойства.
Химические свойства.
1). Диссоциация кислот. Мы рассмотрели с вами строение карбоксильной группы и видели, что карбоновые кислоты могут отщеплять протон. Величина кислотности карбоновых кислот зависит от природы радикала. Обычный алифатический радикал является донором электронной плотности и уменьшает заряд на карбонильном углероде. Поэтому алифатические карбоновые кислоты – слабые, наиболее сильная из них – муравьиная (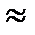 как фосфорная). Чем больше углеродный радикал, тем слабее кислота. Если в радикале появляются электроотрицательные заместители (например, хлор) или бензольное кольцо, то степень диссоциации кислоты увеличивается.
как фосфорная). Чем больше углеродный радикал, тем слабее кислота. Если в радикале появляются электроотрицательные заместители (например, хлор) или бензольное кольцо, то степень диссоциации кислоты увеличивается.
2). Для растворов карбоновых кислот будут возможны все реакции, общие для кислот. Они изменяют окраску индикаторов, потому что в растворах карбоновых кислот кислая среда. Проходят реакции замещения водорода на металл при взаимодействии кислот с некоторыми металлами (до Н), оксидами металлов, щелочами и солями более слабых кислот. Эти реакции можно назвать реакциями электрофильного замещения водорода.
CH3COO H + Na OH  CH3COONa + H2O
CH3COONa + H2O
CH3COO H + Mg  (CH3COO)2Mg + H2
(CH3COO)2Mg + H2
CH3COO H + Na НСO3  CH3COONa + СО2 + H2O
CH3COONa + СО2 + H2O
CH3COO H + Fe 3O3 → (CH3COO)3Fe + H2O
При этом образуются соли карбоновых кислот. Остатки кислот в этом случае называются ацил аты (например: ацетат-соль уксусной кислоты, формиат-соль муравьиной кислоты и т.д.).
3). Для карбоновых кислот (и их производных) характерны так же реакции нуклеофильного замещения. Связанный с атомом углерода карбонильной группы заместитель (у кислот это группа ОН) способен замещаться на нуклеофил. Способность подвергаться атаке нуклеофила возрастают в ряду с увеличением заряда на карбонильном атоме углерода. По сравнению с альдегидами кислоты труднее подвергаются нуклеофильной атаке и нуждаются в катализаторах- кислотах.
Наиболее важные из реакций нуклеофильного замещения – реакции этерификации. Так называют реакции образования сложных эфиров из кислот и спиртов. В отсутствии катализатора реакция протекает очень медленно. В присутствии серной или соляной кислоты реакция заметно ускоряется. Эта реакция обратимая. Обратная реакция относится к реакциям гидролиза. Для увеличения практического выхода и сдвига равновесия в нужную сторону из реакционной смеси надо удалять один из продуктов реакции, например, связывать воду концентрированной серной кислотой.
CH3- CO- OH + C2H5O -H 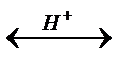 CH3-CO-OC2H5 + H2O
CH3-CO-OC2H5 + H2O
4). Ряд свойств карбоновых кислот обусловлен наличием и характером углеродного радикала. Например, предельные карбоновые кислоты могут вступать в реакцию свободно-радикального замещения, образуя галогензамещенные кислоты.
|
|
|
CH3COOH + Cl2 → CCl3COOH + HCl
Если радикал непредельный, то для него возможны реакции присоединения по двойной связи. Например, реакция гидрирования.
СН2=СН-СООН + Н2 → СН3- СН2 -СООН
Непредельные кислоты способны и к реакциям полимеризации (олифа).
5). Реакции ОВР. Карбоновые кислоты под действием восстановителей ([H] условно) в присутствии катализаторов способны превращаться в альдегиды, спирты и даже углеводороды.
CH3COOH + Н2 → CH3CH=O + Н2O
В атмосфере кислорода, или под действием другого окислителя, карбоновые кислоты окисляются до углекислого газа и воды. Легче всего окисляется муравьиная кислота. (Почему?)
CH3COOH + О2 → СО2+ H2O
6) Обратите внимание! Реакции присоединения по двойной связи, которые характерны для карбонильной группы, для кислот не характерны. Здесь проявляется влияние гидроксогруппы на величину положительного заряда карбонильного атома углерода. Неподеленные электронные пары кислорода из гидроксогруппы смещаются к карбонильному углероду и уменьшают заряд на нем. Поэтому атака нуклеофил на карбонильный углерод становится проблематичной.
 2015-04-17
2015-04-17 3410
3410