Задача 1. Рассчитать рН аммиачного буферного раствора, содержащего 0,02 М раствора NH4ОН и 0,2М раствора NH4Сl. рК(NH4ОН)=4,75,
рОН = 4,74 + 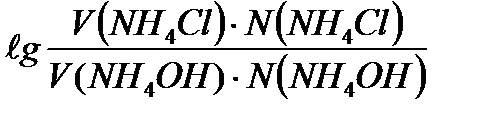
Задача 2. Можно ли приготовить аммиачный буфер с рН = 4,7, когда КД (NH4OH) = 1,8 · 10-5?
Решение:
1. Определяем рК NH4OH:
КД (NH4OH) = 1,8 · 10-5 рК = -lg КД = - lg 1,8 · 10-5 =
-(lg 1,8 - lg 10-5) = -0,26 = 5 = 4,74.
2. Определяем интервал буферного действия по формуле:
рОН = рК ± 1.
рОН = 4, 74 ± 1; рН = 3,74 -5,74.
Ответ: значение рОН = 4,74 входит в интервал рК 3,74 – 5,74, поэтому такой аммиачный буфер можно приготовить.
Задача 3. Для приготовления буфера взяты 70 мл 2 N р-ра NH4OH и 140 мл 0,1 N р-ра NH4С1. Как изменится рОН этого раствора, если: а) этот раствор разбавить в 10 раз, б) добавить к нему 10 мл 0,1 N р-ра NaОН?
КД (NH4OH) = 1,8 · 10-5
Решение:
1. Определяем рК NH4OH:
рК = -lg КД = - lg 1,8 · 10-5 = 4,74 (см. предыдущую з-чу)
2. Определяем начальное значение рОН:
рОН = 4,74 + 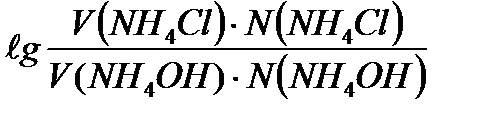
при разбавлении и добавлении NaOH
рОН=4,74+lg 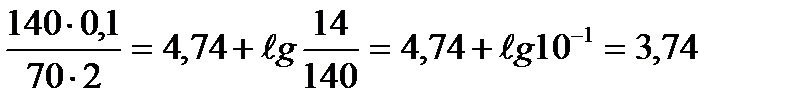
3. Определяем конечное значение рОНК после добавления NaOH:
рОНК = рК +lg + 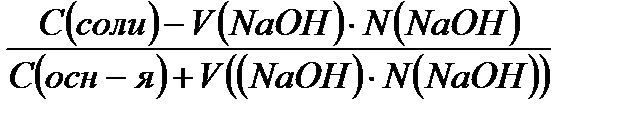 :
:
рОНК = 4,74 +lg + 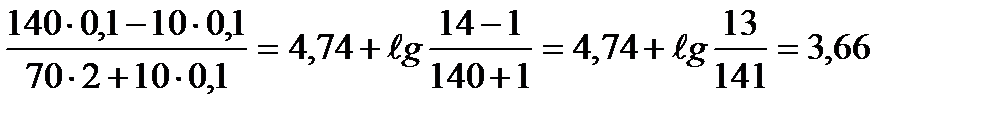 ;
;
4. Определяем изменение рОН (ΔрОН): рОНН – рОНК = 3,74 – 3,66 = 0,08
|
|
|
Ответ: рОН не изменяется при разбавлении буфера в любое число раз, так как при этом не изменится соотношение концентраций компонентов буфера; ΔрОН = 0,08
Задача 4. Какова буферная ёмкость фосфатного буфера, если при добавлении 3 мл 0,01N раствора НС1 к 20 мл этого буфера рН меняется от 7,4 до 7,1?
Решение:
1. Определяем (ΔрН): Δ рН = рНН – рНК, Δ рН = 7,4 – 7,1 = 0,3
2. Определяем буферную ёмкость по формуле:
В = 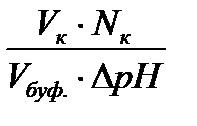 ; В =
; В = 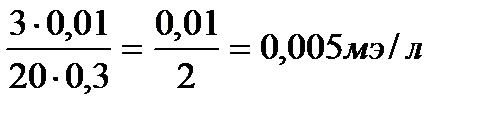
Ответ: В = 0,005 мэ/л.
Вопросы для самоконтроля
1. Какие растворы называются буферными растворами?
2. Классификация буферных растворов.
3. Механизм буферного действия.
4. Уравнение Гендерсона – Гассельбаха для определения рН и рОН протолитических буферных растворов.
5. Факторы, влияющие на рН и рОН буферных растворов.
6. Буферная ёмкость.
7. Зона буферного действия.
8. Количественное определение буферной ёмкости.
9. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая и протеиновая.
10. Взаимодействие буферных систем в организме.
11. Кислотно-основное равновесие.
12. Основные показатели КОР
13. Возможные причины и типы нарушений КОР организма
14. Применение реакции нейтрализации в фармакотерапии для коррекции КОР: лекарственные средства с кислотными и основными свойствами.
 2015-04-01
2015-04-01 31422
31422
