Получение кормовых белковых концентратов с повышенным содержанием незаменимых аминокислот позволяет балансировать корма сельскохозяйственных животных главным образом по уровню белка, тогда как оптимальный аминокислотный состав кормового белка при таком способе балансирования полностью не достигается.
По некоторым аминокислотам почти всегда требуется, для доведения их концентрации в кормовом рационе до оптимума, добавление препаратов чистых аминокислот, полученных промышленным способом. В мире ежегодно производится не менее 300 тыс. т кормовых препаратов незаменимых аминокислот.
Возможно три способа промышленного получения незаменимых аминокислот:
1. Гидролиз белков растительного и микробного происхождения;
2. Микробиологический синтез;
3. Химический синтез.
Более 60% всех производимых промышленностью чистых препаратов аминокислот получают путём микробиологического синтеза. На втором месте по объёму производства находится химический синтез. Основным недостатком химического синтеза является получение смеси аминокислот, состоящей из изомеров, относящихся как к D-, так и к L-ряду, тогда как биологической активностью в организме человека и животных обладают лишь L-формы. D-формы аминокислот не перевариваются ферментными системами этих организмов, а некоторые из них токсичны для человека и животных. Исключением в этом отношении является аминокислота метионин, у которой биологически активны как D-, так и L-формы, в связи с чем данная аминокислота производится преимущественно методом химического синтеза.
Технологически получение аминокислот за счёт гидролиза белков экономически менее выгодно, поэтому не получило широкого распространения.
Путём микробиологического синтеза образуются L-аминокислоты, являющиеся продуктами жизнедеятельности специально подобранных и отселекционированных штаммов микроорганизмов, которые способны накапливать в культуральной жидкости до 150 г /л синтезируемой аминокислоты.
На основе культивирования микроорганизмов с целью получения чистых препаратов аминокислот применяются промышленные технологии, включающие одно- и двухступенчатый синтез аминокислот. При одноступенчатом синтезе:
1.В промышленных культиваторах выращивают ауксотрофные мутанты, являющиеся сверхпродуцентами тех или иных аминокислот;
2. После завершения рабочего цикла их выращивания производится отделение культуральной жидкости от клеток микроорганизмов;
3. Сгущение культуральной жидкости;
4.Получение из культуральной жидкости товарного продукта с высокой концентрацией синтезированной микробами аминокислоты.
В процессе двухступенчатого синтеза аминокислоты:
1. Вначале получают её предшественника более дешёвым химическим синтезом;
2. Затем с помощью ферментов, вырабатываемых микроорганизмами, производится превращения предшественника в аминокислоту, при этом образуется только L-форма.
В качестве источника фермента могут быть использованы либо суспензия клеток микроорганизмов, либо полученный после разрушения этих клеток ферментный раствор.
Микробиологический синтез лизина. Белки семян зерновых культур (пшеницы, ячменя, кукурузы и др.) не сбалансированы по содержанию незаменимых аминокислот и прежде всего лизина. Поэтому для удовлетворения потребностей животноводства в России, Японии, Франции, Испании, Югославии организовано крупнотоннажное производство этой незаменимой аминокислоты. В основу производства положены технологии с использованием одноступенчатого микробиологического синтеза, которые включают промышленное культивирование ауксотрофных мутантов бактерий (мутантные штаммы микроорганизмов, не способные к синтезу определённых ферментов) из рода Corynebacterium, способных к сверхсинтезу этой аминокислоты. Обычно у диких штаммов, из которых получены ауксотрофные мутанты, сверхсинтеза лизина не наблюдается, так как у них действуют механизмы саморегуляции.
В клетках бактерий аминокислота лизин синтезируется из аспарагиновой кислоты через ряд промежуточных этапов, связанных с образованием полуальдегида аспарагиновой кислоты и α,є-диаминопарагиновой кислоты, являющейся непосредственным предшественником лизина. Полуальдегид аспарагиновой кислоты также является предшественником в синтезе аминокислот – треонина, метионина и изолейцина (рис. 12.4).
В соответствии со схемой превращения аминокислот для снятия регуляции синтеза лизина необходимо прекратить образование треонина на стадии превращения полуальдегида аспарагиновой кислоты в гомосерин, катализируемого ферментом гомосериндегидрогеназой. Последнее достигается посредством мутагенеза.
Опыты показывают, что мутантные клетки, не образующие гомосериндегидрогеназы, при их культивировании на искусственной питательной среде обеспечивают высокий выход лизина. Дефицитные аминокислоты, которые не синтезируются мутантными клетками (гомосерин, треонин, метионин), вводятся в состав питательной среды в таком количестве, чтобы они не были регуляторами синтеза лизина.
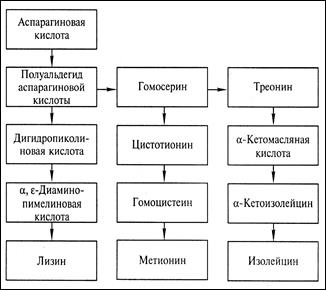
Рис. 12.4. Схема превращения аминокислот
 2015-04-30
2015-04-30 4491
4491