Растворы слабых кислот или оснований в присутствии их солей проявляют буферное действие: рН таких растворов мало изменяется при разбавлении и добавлении к ним небольших количеств сильной кислоты или щелочи.
Для вычисления концентрации водородных ионов в буферных растворах применимы уравнения (1.88) и (1.91). рН буферного раствора, содержащего слабую кислоту и ее соль, будет равен
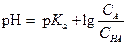 | (1.107) |
Для рН буферной смеси, состоящей из слабого основания и его соли, имеем следующее выражение:
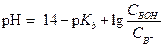 | (1.108) |
Если буферная смесь состоит из средней соли (М2А) и кислой соли (МНА) двухосновной кислоты, то
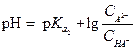 | (1.109) |
где 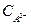 и
и  - концентрации солей М2А и МНА,
- концентрации солей М2А и МНА, 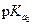 - показатель константы диссоциации кислоты Н2А по второй ступени.
- показатель константы диссоциации кислоты Н2А по второй ступени.
Если буферная смесь образована кислыми солями (М2НА, МН2А) трехосновной кислоты, то для расчета рН применимо уравнение
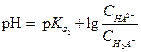 | (1.110) |
Буферное действие характеризуется буферной емкостью (π). Буферная емкость измеряется количеством сильного основания (b) или кислоты (а), которое необходимо добавить к данному раствору, чтобы изменить рН на единицу.
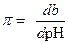 | (1.111) |
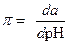 | (1.112) |
В области максимального буферного действия буферная емкость раствора, содержащего слабую кислоту (НА) и ее соль (МА), выражается уравнением
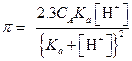 | (1.113) |
СА - общая концентрация раствора (СА = [НА] + [A-). Максимальное значение буферная емкость при данной концентрации С А имеет при [Н+] = K а.
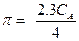 | (1.114) |
Достаточное буферное действие проявляется в интервале
| pH=pKa±1 | (1.115) |
При определении буферной емкости раствора, состоящего из слабого основания и его соли, в формулу (1.113) вместо Ка вводится константа сопряженной кислоты 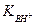 в соответствии с равенством (1.77).
в соответствии с равенством (1.77).
Пример 26. К 15 мл 0.03 М раствора муравьиной кислоты прибавлено 12 мл 0.15 М раствора формиата калия. Вычислить рН этой смеси.
Решение. Найдем концентрацию кислоты и ее аниона после смешения двух растворов:
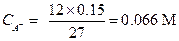 | |
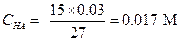 |
Подставляя эти значения в уравнение (1.88), найдем
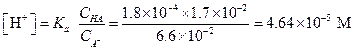 pH = 4.43 pH = 4.43 |
Эту задачу можно решить более просто, если концентрацию кислоты и соли выразить в миллимолях (мМ), учитывая, что объем раствора после разбавления входит в числитель и знаменатель данного выражения.
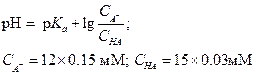 |
Подставляя эти значения в выражения для рН, получим
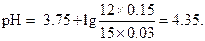 |
Пример 27. Смешано 10 мл 0.3 М раствора НС1 и 20 мл 0.2 М раствора аммиака. Определить рН полученного раствора.
Решение. В данном примере буферная смесь образовалась в результате реакции
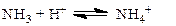 |
Концентрация соли NH4C1 (C B+) равна взятой концентрации НСl с учетом разбавления раствора
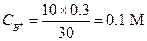
Концентрацию NH3 (СBOH) находим по разности между начальной концентрацией 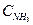 (с учетом разбавления) и концентрацией НС1
(с учетом разбавления) и концентрацией НС1
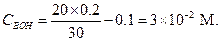
Подставляя эти значения в уравнение (1.91), найдем [OH-]:
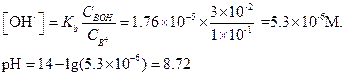
Если выразить концентрацию НС1 и NH3 в мМ, то решение можно провести следующим образом:
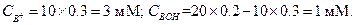
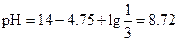
Пример 28. К 20 мл 0.2 М раствора гидрофосфата калия добавлено 10 мл 0.25 М раствора НСl. Определить рН полученного раствора.
Решение. При смешении данных растворов происходит следующая реакция:
К2НРО4 + НС1 = КН2РО4 + КС1.
В результате образовалась буферная смесь, состоящая из КН2РО4 и К2НРО4. Концентрации анионов Н2РО4- и НРО42- равны
[Н2РО4-] = 10×0.25 2.5 мМ; [НРО42-] = 20×0.2 - 10×0.25 = 1.5 мМ.
используя уравнение (1.110), находим рН
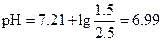
Пример 29. Сколько г ацетата натрия надо добавить к 200 мл 0.2 М раствора НСl, чтобы рН = 4.5?
Решение. Напишем уравнение реакции
CH3COONa + HC1 = СН3СООН + NaCl.
В результате данной реакции образовалась уксусная кислота, концентрация которой равна концентрации НС1 (С НА = 0.2). Равновесная концентрация анионов СН3СОО- определяется по разности между начальной концентрацией соли (х), и концентрацией НС1
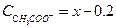
Подставляем данные значения в уравнение (1.107) и находим х
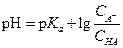
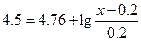
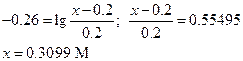
Количество CH3COONa в г на 200 мл (В) равно
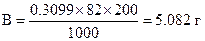
Пример 30. Вычислить буферную емкость раствора, состоящего из 1.140 М СН3СООН и 0.205 М CH3COONa, рН = 4.
Решение. Находим общую концентрацию компонентов
С А = 1.140 + 0.205 = 1.345 М.
Подставив в формулу (1.113), получим:
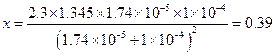
Пример 31. Буферный раствор, приготовленный из раствора аммиака и хлорида аммония, имеет рН = 10. Вычислить буферную емкость этого раствора, если общая концентрация СА= 0.336 М.
Решение. Константа диссоциации сопряженной кислоты согласно реакции
 |
равна
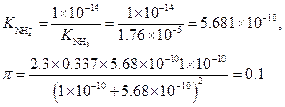
 2015-05-13
2015-05-13 5106
5106
