Если процесс протекает самопроизвольно, то внутренняя энергия (энтальпия) должны уменьшаться, а энтропия увеличиваться. Для сравнения этих величин их надо выразить в одних единицах, а для этого Δ S умножить на T. В этом случае имеем Δ Н – энтальпийный фактор и Т Δ S - энтропийный фактор.
В ходе реакции частицы стремятся к объединению, что ведет к уменьшению энтальпии (Δ Н < 0), с другой стороны – должна возрастать энтропия, т.е. увеличиваться число частиц в системе (Т Δ S > 0). "Движущая сила" реакции определяется разностью между этими величинами и обозначается Δ G.
Δ G p,T = Δ H – T Δ S
и называется изменением энергии Гиббса (изобарно-изотермический потенциал).
Энергия Гиббса - это часть энергетического эффекта реакции, которую можно превратить в работу, поэтому ее называют свободной энергией. Это тоже термодинамическая функция состояния и, следовательно, для реакции
b B + d D = l L + m M,
энергию Гиббса химической реакции можно рассчитать как сумму энергий Гиббса образования продуктов реакции за вычетом энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов по формуле:
|
|
|
Δ G = l Δf G L + m Δf G M – d Δf G D – b Δf G B.
где Δf G – энергия Гиббса образования веществ.
Энергия Гиббса образования веществ это изменение энергии Гиббса системы при образовании 1 моль вещества из простых веществ, устойчивых при 298 К.
Энергия Гиббса образования простых веществ Δf G принимается равной нулю. Если образующееся вещество и исходные простые вещества находятся в стандартных состояниях, то энергия Гиббса образования называется стандартной энергией Гиббса образования вещества Δf G 0. Ее значения приводятся в справочниках.
Полученное значение Δ G является критерием самопроизвольного течения реакции в прямом направлении, если Δ G < 0. Химическая реакция не может протекать самопроизвольно в прямом направлении, если энергия Гиббса системы возрастает, т.е. Δ G > 0. Если Δ G = 0, то реакция может протекать как в прямом, так и в обратном направлениях, т.е. реакция обратима.
Направление химических реакций зависит от их характера. Так, условие Δ G < 0 соблюдается при любой температуре для экзотермических реакций (Δ Н < 0), у которых в ходе реакции возрастает число молей газообразных веществ, и, следовательно, энтропия (Δ S > 0). У таких реакций обе движущие силы (Δ Н) и (Т Δ S) направлены в сторону протекания прямой реакции и Δ G < 0 при любых температурах. Такие реакции являются необратимыми.
Наоборот, эндотермическая реакция (Δ Н > 0), в результате которой уменьшается число молей газообразных веществ (Δ S < 0) не могут протекать самопроизвольно в прямом направлении при любой температуре, т.к. всегда Δ G > 0.
|
|
|
Если в результате экзотермической реакции (Δ Н < 0) уменьшается число молей газообразных веществ и, соответственно, энтропия (Δ S < 0), то при невысокой температуре Δ Н > T Δ S и реакция возможна в прямом направлении (Δ G < 0). При высоких температурах Δ H < T Δ S и прямая реакция самопроизвольно протекать не может (Δ G > 0), а обратная реакция возможна.
Для определения температуры равновесия можно воспользоваться условием:
Т р = Δ Н /Δ S,
где Т р – температура, при которой устанавливается равновесие, т.е. возможность протекания прямой и обратной реакций.
Если в результате эндотермической реакции (Δ Н > 0) увеличивается число молей газообразных веществ и энтропия системы (Δ S > 0), то при невысоких температурах, когда Δ Н > Т Δ S, самопроизвольно прямая реакция идти не может (Δ G > 0), а при высоких температурах, когда Δ Н < T Δ S, прямая реакция может протекать самопроизвольно (Δ G < 0).
Связь между Δ G и Δ G 0 выражается уравнением изотермы Вант-Гоффа, которая для реакции
b B + d D = l L + m M
записывается в виде:
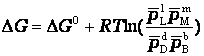
либо в виде:
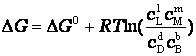
где 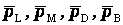 - относительные парциальные давления соответствующих веществ;
- относительные парциальные давления соответствующих веществ; 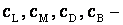 концентрации соответствующих растворенных веществ.
концентрации соответствующих растворенных веществ.
Итак, энергия Гиббса позволяет определить возможность протекания реакции расчетным путем, не прибегая к дорогостоящим и длительным экспериментам.
В изохорно-изотермических условиях свободная энергия называется энергией Гельмгольца или изохорно-изотермическим потенциалом и равна
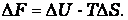
Она характеризует направление и предел самопроизвольного течения химической реакции при изохорно-изотермических условиях, которое возможно при Δ F < 0.
5 Распределение Максвелла для скоростей.
МАКСВЕЛЛА РАСПРЕДЕЛЕНИЕ
распределение по скоростям молекул (ч-ц) макроскопич. физ. системы, находящейся в статистич. равновесии, при условии, чтодвижение молекул подчиняется законам классич. механики (пример — классический идеальный газ). Установлено Дж. Максвеллом в 1859. Согласно М. р., вероятное число молекул в ед. объёма f(v), компоненты скоростей к-рых лежат в интервалах от vx до vx+dvx, от vy до vy+dvy и от vz до vz+dvz, определяются ф-цией распределения Максвелла
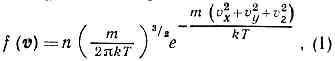
где т — масса молекулы, n — число молекул в ед. объёма. Отсюда следует, что число молекул, абс. значения скоростей к-рых лежат в интервале от v до v+dv, также называемое М. р., имеет вид:
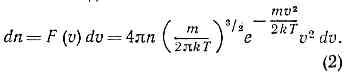
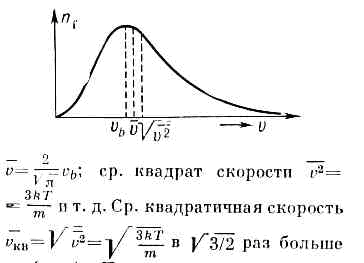
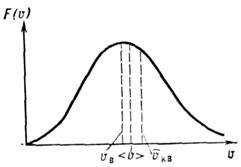
Оно достигает максимума при скорости vb=?(2kT/m), наз. Наиболее вероятной скоростью. Для мол. водорода при T=273 К vb=1506 м/с. При помощи М. р. можно вычислить ср. значение любой ф-ции от скорости молекулы: ср. скорость vb (рис.).
При возрастании темп-ры максимум М. р. (значение vb) смещается к более высоким темп-рам. М. р. не зависит от вз-ствия между молекулами и справедливо не только для газов, но и для жидкостей, если для них возможно классич. описание. Оно справедливо также и для броуновских ч-ц (см. БРОУНОВСКОЕ ДВИЖЕНИЕ), взвешенных в жидкости или газе. М. р. может быть получено из канонического распределения Гиббса для классич. системы интегрированием по всем координатам ч-ц, т. к. в этом случаераспределение по скоростям не зависит от распределения по импульсам. М. р. есть решение кинетического уравнения Больцмана для частного случая статистич. равновесия.
М. р. было подтверждено экспериментально нем. физиком О. Штерном (1920) в опытах с мол. пучками.
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
МАКСВЕЛЛА РАСПРЕДЕЛЕНИЕ
-распределение по скоростям частиц (молекул) макроскопич. физ. системы, находящейся в статистич. равновесии, в отсутствие внеш. поля при условии, что движение частиц подчиняется законам классич. механики. Установлено Дж. К. Максвеллом (J. С. Maxwell) в 1859. Согласно M. р., вероятное число частиц в единице объёма, компоненты скоростей к-рых лежат в интервалах от Vx до 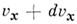 , от
, от 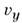 до
до 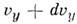 и от
и от 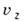 до
до  , равно
, равно 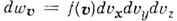 , где
, где 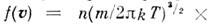
|
|
|
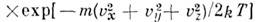 - ф-ция распределения Максвелла по скоростям, n - число частиц в единице объёма, т - масса частицы, T - абс. темп-ра. Отсюда следует, что число частиц, абс. значения скоростей к-рых лежат в интервале от и до u + du, равно
- ф-ция распределения Максвелла по скоростям, n - число частиц в единице объёма, т - масса частицы, T - абс. темп-ра. Отсюда следует, что число частиц, абс. значения скоростей к-рых лежат в интервале от и до u + du, равно
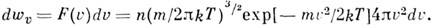
Это распределение наз. M. р. по абс. значениям скоростей. Ф-ция F(V)достигает максимума при скорости 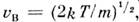 наз. наиб, вероятной скоростью. Для молекул H2 при T -273К uB ~ 1500 м/с. При помощи M. р. можно вычислить ср. значение любой ф-ции от скорости молекул: ср. квадрат скорости
наз. наиб, вероятной скоростью. Для молекул H2 при T -273К uB ~ 1500 м/с. При помощи M. р. можно вычислить ср. значение любой ф-ции от скорости молекул: ср. квадрат скорости 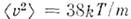 ср. квадратичную скорость
ср. квадратичную скорость 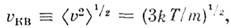 ср. арифметич. скорость
ср. арифметич. скорость 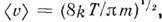 к-рая в
к-рая в
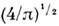 раза больше uB (рис.).
раза больше uB (рис.).
M. р. по относит, скоростям молекул и имеет вид
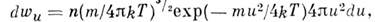
откуда следует, что ср. относит, скорость молекул равна 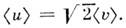
M. р. не зависит от взаимодействия между молекулами и справедливо не только для газов, но и для жидкостей, если для них возможно классич. описание.
В случае многоатомных молекул M. р. имеет место для постунат. движения молекул (для скорости их центра тяжести) и не зависит от внутримолекулярного движения и вращения даже в том случае, когда для них необходимо квантовое описание. M. р. справедливо для броуновского движения частиц, взвешенных в жидкости или газе.
Максвелл использовал для обоснования M. р. детального равновесия принцип. M. р. можно получить из канонического распределения Гиббса для классич. системы, интегрируя по всем пространственным координатам и по всем скоростям, кроме одной, т. к. в классич. случае распределение по скоростям не зависит от распределения по пространственным координатам. M. р. является частным решением кинетического уравнения Больцмана для случая статистич. равновесия в отсутствио впеш. полей. M. р. обращает в нуль интеграл столкновения этого ур-ния, выражающего баланс между прямыми и обратными столкновениями. Во внеш. потенциальном поле имеет место распределение Максвелла - Больцмана (см. Болъцма-на распределение). M. р.- предельный случай Базе - Эйнштейна распределения и Ферми - Дирака распределения в случае, когда можно пренебречь явлением квантового вырождения газа. M. р. подтверждено экспериментально О. Штерном (О. Stern) в 1920 в опытах с молекулярными пучками от источника, помещённого внутри вращающейся цилиндрич. поверхности, и позднее (1947) в опытах И. Эстермана (I. Estermann), О. Симпсона (О. Simpson) и Штерна по свободному падению молекул пучка под действием силы тяжести.
|
|
|
6 Удельная теплоемкость твердых тел.
Наиболее важными способами поглощения тепловой энергии твердым телом являются:
• увеличение интенсивности колебаний атомов;
• увеличение энергии поступательного движения электронов;
• увеличение вращательной энергии молекул.
Первый механизм присущ всем твердым тела. Этот механизм наиболее важен из всех трех. Другие эффекты могут преобладать только в узких температурных интервалах.
Общая энергия твердого тела, как было показано в предыдущей главе, складывается из двух слагаемых. Одним из них является тепловая энергия, другим − энергия, которой обладают твердые тела при абсолютном нуле температуры. Сумма этих величин является внутренней энергией 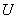 . Эта величина может быть точно определена из эксперимента. Однако исторически сложилось так, что большее внимание уделялось величине теплоемкости твердого тела.
. Эта величина может быть точно определена из эксперимента. Однако исторически сложилось так, что большее внимание уделялось величине теплоемкости твердого тела.
Теплоемкость тела при постоянном объеме 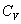 (V = const) или постоянном давлении
(V = const) или постоянном давлении 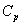 (p = const) определяется как производная от энергии тела по температуре. При изучении твердых тел из эксперимента обычно определяется теплоемкость при постоянном давлении
(p = const) определяется как производная от энергии тела по температуре. При изучении твердых тел из эксперимента обычно определяется теплоемкость при постоянном давлении 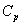 , однако более фундаментальной величиной в физике твердого тела являетсятеплоемкость при постоянном объеме
, однако более фундаментальной величиной в физике твердого тела являетсятеплоемкость при постоянном объеме 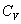 , связанная с
, связанная с 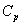 соотношением
соотношением
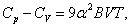
| (6.1) |
где a – линейный коэффициент теплового расширения; B – модуль объемной упругости (всестороннего сжатия). Относительная величина разности (6.1) невелика, и при температурах ниже комнатной ею обычно можно пренебречь.
Будем в дальнейшем рассматривать теплоемкость при постоянном объеме 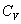 , которую можно определить по формуле
, которую можно определить по формуле
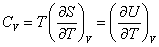 , ,
| (6.2) |
где S – энтропия кристалла.
7 Положения статистической термодинамики.
Статистическая термодинамика равновесная, раздел статистической физики, дающий статистическое обоснование законов термодинамики основе статистической механики Дж. У. Гиббсаи посвященный вычислениям термодинамических характеристик системы (потенциалы термодинамические, уравнение состояния) на основе законов взаимодействия составляющих систему частиц. Неравновесная С. т. даёт статистическое обоснование термодинамики неравновесных процессов (уравнений переноса энергии, импульса, массы) и позволяет получить выражения для входящих в уравнения коэффициентов (кинетических коэффициентов, или коэффициентов переноса) на основе законов взаимодействия и движения частиц системы.
Статистическая термодинамика — раздел статистической механики и термодинамики; включает:
§ равновесную статистическую термодинамику, посвященную обоснованию законов термодинамикиравновесных процессов (на основе статистической механики Дж. У. Гиббса) и вычислениям характеристик термодинамических систем (термодинамических потенциалов и др.), уравнения состояния на основе законов взаимодействия составляющих эти системы частиц;
§ неравновесную статистическую термодинамику, которая даёт статистическое обоснованиетермодинамики неравновесных процессов (уравнений переноса энергии, импульса, массы) и позволяет получить выражения для входящих в уравнения переноса коэффициентов (кинетических коэффициентов) на основе законов взаимодействия и движения частиц термодинамической системы.
 2015-05-13
2015-05-13 7591
7591
