П р и м е р 1. Определить адиабатическую температуру горения этилового спирта в воздухе.
Р е ш е н и е. Расчет проводим по схеме, приведенной в табл. 1.7.
1. Так как горючее - индивидуальное вещество, для определения объема и состава продуктов горения запишем уравнение химической реакции горения
C2H5OH + 3O2 + 3×3,76N2 = 2CO2 + 3H2O + 3×3,76N2.
Следовательно, продукты горения состоят из: 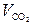 = 2 моля,
= 2 моля,
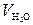 =3 моля,
=3 моля, 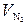 = 11,28 моля,
= 11,28 моля, 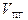 = 16,28 моля.
= 16,28 моля.
2. Низшую теплоту сгорания определим по формуле (1.30). Из табл.3 приложения находим теплоту образования горючего - 278,2 кДж/моль
Q Н = 2×396,9 + 3×242,2 - 278,2 = 1242,2 кДж/моль.
3. Средняя энтальпия продуктов горения
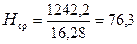 кДж/моль.
кДж/моль.
4. Так как H ср выражена в кДж/моль, по табл. 1 а приложения выбираем, ориентируясь на азот, первую приближенную температуру горения Т 1 = 2100 oС.
5. Рассчитываем теплосодержание продуктов горения при 2100 оС по формуле (1.41)
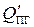 = 114,7×2 + 93,4×3 + 70,4×11,28 = 1303,7 кДж/моль.
= 114,7×2 + 93,4×3 + 70,4×11,28 = 1303,7 кДж/моль.
6. Сравниваем 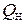 и
и 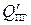 , так как
, так как 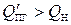 , выбираем температуру горения равной 2000 оС.
, выбираем температуру горения равной 2000 оС.
7. Рассчитываем теплосодержание продуктов горения при 2000 оС:
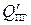 = 108,6×2 + 88,1,6×3 + 66,8×11,28 = 1235 кДж/моль.
= 108,6×2 + 88,1,6×3 + 66,8×11,28 = 1235 кДж/моль.
8. Так как 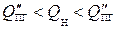 , определим температуру горения по формуле (1.42)
, определим температуру горения по формуле (1.42)
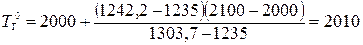 оС.
оС.
П р и м е р 2. Определить адиабатическую температуру горения органической массы, состоящей из С – 60 %, Н – 7 %, О – 25 %, W – 8 %.
Р е ш е н и е. 1. Так как горючее представляет собой сложное вещество, состав продуктов горения рассчитываем по формулам (1.19 - 1.21)
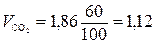 м3/кг;
м3/кг; 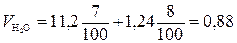 м3/кг;
м3/кг;
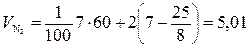 м3/кг.
м3/кг.
Общий объем продуктов горения равен 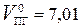 м3/кг.
м3/кг.
2. Определим низшую теплоту cгорания вещества по формуле
Д.И. Менделеева (1.31)
Q Н= 339,4×60 + 1157×7 - 108,9×25 - 25,1(9×7 + 8)= 23958,4 кДж/кг.
3. Определим среднюю энтальпию продуктов горения
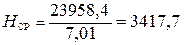 кДж/м3.
кДж/м3.
4. Так как величина энтальпии рассчитана в кДж/м3, первую приближенную температуру выбираем по табл. 1 б приложения. Ориентируясь на азот, принимаем Т 1 = 2100 оС.
5. Рассчитываем теплосодержание продуктов горения при 2100 оС по формуле (1.41)
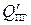 = 5118,2×1,12 + 4166,1×0,88 + 3142,9×5,01 = 25144,5 кДж/кг
= 5118,2×1,12 + 4166,1×0,88 + 3142,9×5,01 = 25144,5 кДж/кг
6. Из сравнения Q Н и 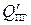
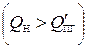 выбираем вторую приближенную температуру, равную 1900 оС.
выбираем вторую приближенную температуру, равную 1900 оС.
7. Рассчитываем теплосодержание продуктов горения при 19000С
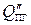 = 4579,7×1,12 + 3693,5×0,88 + 2818,2×5,1 = 22498,8 кДж/кг.
= 4579,7×1,12 + 3693,5×0,88 + 2818,2×5,1 = 22498,8 кДж/кг.
8. Так как 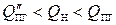 , определим температуру горения
, определим температуру горения
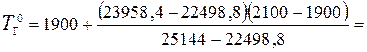 2010 оС.
2010 оС.
П р и м е р 3. Рассчитать действительную температуру горения фенола (D H обр = 4,2 кДж/моль), если потери тепла излучением составили 25 % от Qн, а коэффициент избытка воздуха при горении 2,2.
Р е ш е н и е. 1. Определим состав продуктов горения:
C6H5OH + 7O2 + 7×3,76N2 = 6CO2 + 3H2O + 7×3,76N2,
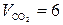 моль;
моль; 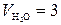 моля;
моля; 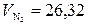 моля,
моля,
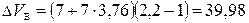 моля,
моля, 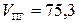 моля.
моля.
2. Определим низшую теплоту сгорания фенола (формула 1.30):
Q Н = 7×396,9 + 3×242,2 - 1×4,2 = 3500,7 кДж/моль,
так как по условию задачи 25 % тепла теряется, определим количество тепла, пошедшее на нагрев продуктов горения (теплосодержание продуктов горения при температуре горения) (формула 1.39)
Q ПГ = 3500,7(1 - 0,25) = 2625,5 кДж/моль.
По формуле (1.43) определим действительную температуру горения
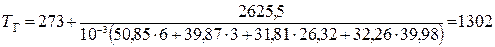 К.
К.
П р и м е р 4. Рассчитать температуру взрыва метановоздушной смеси стехиометрического состава.
Р е ш е н и е. Расчет проводим по схеме, представленной в табл. 1.7.
1. Объем и состав продуктов горения
СН4 + 2О2 + 2×3,76N2 = СО2 + 2Н2О + 2×3,76N2.
Продукты горения: 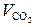 = 1 кмоль/кмоль,
= 1 кмоль/кмоль, 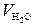 = 2 моль/моль,
= 2 моль/моль, 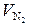 = 2×3,76 = 7,5 кмоль/кмоль.
= 2×3,76 = 7,5 кмоль/кмоль.
2. Низшая теплота сгорания:
Q Н= 1×396,6 + 2×242,2 – 75 = 806 кДж/моль.
3. Средняя внутренняя энергия продуктов горения
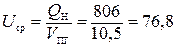 кДж/моль.
кДж/моль.
4. По табл. 2 приложения принимаем первую приближенную температуру взрыва (по азоту) Т 1 = 2700 оС.
5. Рассчитываем внутреннюю энергию продуктов горения при Т1:
U 1 = å V пг i×Ui = 1×128,9 + 2×102,4 + 7,5×70,2 = 860,2 кДж/моль.
6. Сравнение значение Q Н и U 1 показывает, что Т 1 завышена.
7. Выбираем Т 2 = 2500 оС.
U 2 = 1×118,3 + 2×94,3 + 7,5×64,3 = 789,2 кДж/моль.
8. Так как U 1 > Q Н > U 2
Т взр= 2500 + 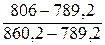 (2700 – 2500)» 2524 оС.
(2700 – 2500)» 2524 оС.
 2015-06-10
2015-06-10 1588
1588