Расчет адиабатных температур взаимодействия (горения)
Продолжим раздел «Термодинамика реакций высокотемпературного синтеза».
Одной из важнейших задач в исследовании процессов высокотемпературного синтеза является оценка максимальных температур, развивающихся при взаимодействии (горении) исходных компонентов реакции.
Зависимость теплового эффекта реакции от температуры
Изменение энтальпии веществ в зависимости от температуры описывается соотношением:
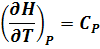 (12)
(12)
Откуда
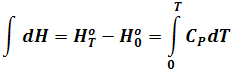
Для другой базовой температуры имеем:
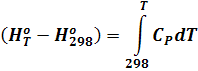
Значения 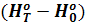 и
и 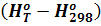 - функции энтальпии - табулированы.
- функции энтальпии - табулированы.
Уравнение Киркоффа связывает изменение теплового эффекта реакции с температурой:
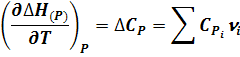 (13)
(13)
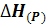 - тепловой эффект реакции
- тепловой эффект реакции
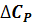 - изменение теплоемкости сложной системы
- изменение теплоемкости сложной системы
Из уравнения (13) следует, что знак производной 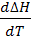 определяется разностью теплоемкостей продуктов реакции и исходных веществ - при DG > 0,
определяется разностью теплоемкостей продуктов реакции и исходных веществ - при DG > 0, 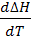 > 0 и наоборот.
> 0 и наоборот.
Если сумма теплоемкостей продуктов реакции больше суммы теплоемкостей исходных веществ 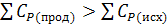 , то тепловой эффект возрастает с повышением температуры.
, то тепловой эффект возрастает с повышением температуры.
|
|
|
Из уравнения Киркоффа (13) можно определить тепловой эффект реакции при любых температурах:
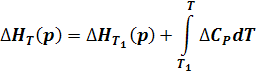 (14)
(14)
Из уравнения (14) можно получить уравнение зависимости теплового эффекта реакции от температуры:
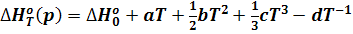 (15)
(15)
Тепловой эффект сложной системы
Рассмотрим сложную систему, в которой реакция протекает в неизотермических условиях.
В сложной системе необходимо учитывать
ü теплообмен между системой и окружающей средой,
ü присутствие инертных веществ.
Такими сложными системами являются реакции высокотемпературного синтеза.
Тепловой эффект реакции при постоянном давлении, в которой реагенты находятся при температуре Т1, а продукты реакции при температуре Т2 является разностью функций состояния DН. Поэтому он определяется только начальным и конечным состоянием системы и не зависит от пути изменения состояния системы.
Переход системы из начального состояния в конечное можно представить в виде ряда стадий (а именно трех), одной из которых является экзотермическая реакция при постоянных давлении и температуре (искусственно).
Две другие стадии можно рассматривать как теплообмен только реагентов, или только продуктов с окружающей средой при переменной температуре.
Рассмотрим энтальпийно-температурную диаграмму.
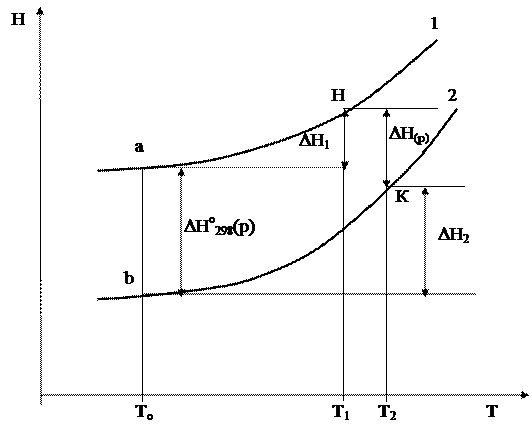
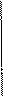 1- реагенты
1- реагенты
2- продукты
Чем выше температура, тем больше содержится тепла, но кривые идут не параллельно из-за разной теплоемкости веществ.
Переход системы из начального состояния Н в конечное К можно представить как совокупность стадий.
Из диаграммы следует
DН(р) + DН2 = DНо298(р) + DН1 или
DН(р) = DНо298(р) + DН1 - DН2
|
|
|
Переход a - b - стандартный тепловой эффект реакции при То (298,15°С):
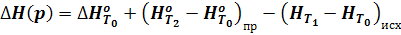
При изменении температуры То - Т1 - Т2 возможны фазовые превращения. В общем виде можно записать:
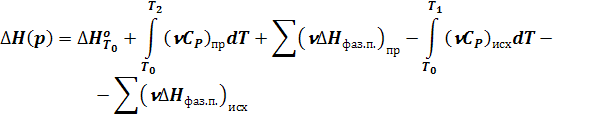 (16)
(16)
Полный тепловой эффект - это количество теплоты, которым система обменивается с окружающей средой при переходе из исходного состояния Н в конечное К.
Уравнение (16) можно использовать для определения температуры Т2, которую получают продукты реакции, если известны:
ü начальная температура Т1 реагентов,
ü стандартный тепловой эффект реакции 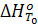 ,
,
ü количество теплоты, переданное системой 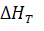 ,
,
ü удельные теплоемкости Ср компонентов системы.
 Здесь возможны четыре частных случая.
Здесь возможны четыре частных случая.
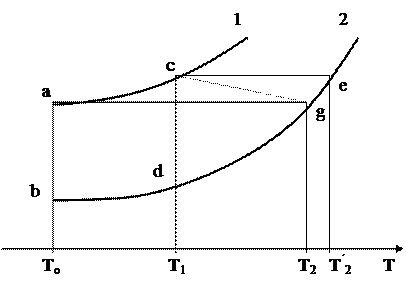 |
1. Изотермическая реакция a - b при стандартной температуре, когда реагенты входят, а продукты реакции покидают систему при температуре равной Т = То = 298,15°С.
DН = DНо298
2. Изотермическая реакция c - d при температуре, отличающейся от стандартной, когда реагенты входят в систему, а продукты реакции покидают систему при одной и той же, но не стандартной температуре Т1.
Изменение энтальпии системы можно определить на основе рассмотрения эквивалентного пути c - a - b - d.
DН = Hd - Hc = (Hd - Hb) + (Hb - Ha) + (Ha - Hc)
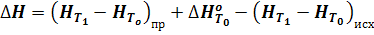
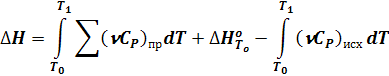 (17)
(17)
3. Неизотермическая реакция c - g, когда реагенты входят в систему при температуре Т1, а продукты реакции покидают систему при температуре Т2.
Изменение энтальпии определяют на основе эквивалентного пути c - a - b - g.
DН = Hg - Hc = (Hg - Hb) + (Hb - Ha) + (Ha - Hc)
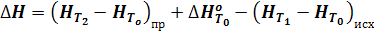
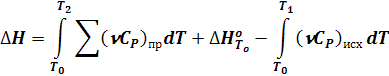 (18)
(18)
4. Адиабатическая реакция a - g, которая связана с понятием адиабатной температуры взаимодействия.
Адиабатная температура взаимодействия (горения)
В отсутствии теплообмена между системой и окружающей средой (адиабатическая реакция) изменение энтальпии системы равно нулю (переход a - g).
В этом случае конечная температура называется адиабатной температурой взаимодействия (горения). Она может быть найдена из выражения для изменения энтальпии DН = Hg - Ha на основе эквивалентного пути a - b - g.
DН(р) = Hg - Hа = (Hg - Hb) + (Hb - Ha) = 0
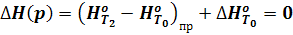
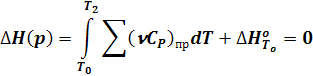
Отсюда
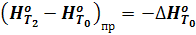
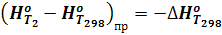
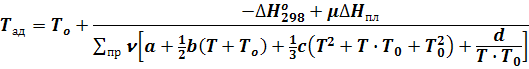 (19)
(19)
где µ - доля жидкой фазы (расплавленного продукта), изменяется от 0 до 1:
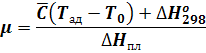
тогда
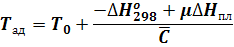
Отсюда, найдем выражение для вычисления средней теплоемкости:
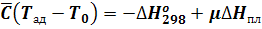
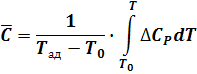
Действительная температура, которую имеют продукты реакции оказывается ниже теоретической адиабатной температуры.
Это может быть по следующим причинам:
- реакция протекает не при адиабатических условиях,
- часть теплоты расходуется на нагрев избытка реагента,
- часть теплоты расходуется на нагрев инерта,
- возможно неполное реагирование,
- диссоциация продукта поглощает значительное количество тепла.
 2014-02-05
2014-02-05 1409
1409






