ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО РЫБОЛОВСТВУ
Федеральное государственное БЮДЖЕТНОЕ образовательное учреждение
высшего профессионального образования
«МУРМАНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
(ФГБОУ ВПО «МГТУ»)
Кафедра химии
РЕФЕРАТ
ПО ДИСЦИПЛИНЕ «НЕОРГАНИЧЕСКАЯ ХИМИЯ»
КИСЛОРОДНЫЕ СОЕДИНЕНИЯ АЗОТА
Выполнил: студент группы х(б)111-(1)
Титов Р.А.
Руководитель: к.х.н., доцент
Дякина Т.А.
Мурманск
Оглавление
Введение……..……………………………………….………………………………3
Азот в природе…………………………………………….............................4
Химические свойства, строение молекулы…………….…..……………….5
Оксиды азота…………………………………….…………………………….....….6
N2O(Оксонитрид азота(I))…………………………………….………...…..8
NO (Оксид азота (II)) …………………………………..…..………………..11
N2O3 (Оксид азота(III)) ……………………………….…………………..…15
NO2 (Оксид азота (IV)) ……………………………………………..……..…17
N2O5 (Оксид азота(V)) ………………….……………………………………20
NO3 (Триоксид азота) ………………………………………….……….……21
N4O (Нитрозилазид) …………………………………...............………….…21
N(NO2)3 (Тринитрамид) ………..………………………………….…...……22
Вывод……………………………………………………………………..……….…23
Список литературы…………………………………………………………...….....24
Введение
Азот — элемент 15-й группы второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 7. Простое вещество азот - достаточно инертный при нормальных условиях двухатомный газ без цвета, вкуса и запаха, из которого на три четверти состоит земная атмосфера.
История открытия
В 1772 году азот (под названием «испорченного воздуха») как простое вещество описал Даниэль Резерфорд, он опубликовал магистерскую диссертацию, где указал основные свойства азота (не реагирует со щелочами, не поддерживает горения, непригоден для дыхания). Именно Даниэль Резерфорд и считается первооткрывателем азота. В дальнейшем азот был изучен Генри Кавендишем.
Азот (от др.-греч. ἄζωτος — безжизненный, лат. nitrogenium), предложил в 1787 году Антуан Лавуазье, который в то время в составе группы других французских учёных разрабатывал принципы химической номенклатуры. В то время уже было известно, что азот не поддерживает ни горения, ни дыхания. Это свойство и сочли наиболее важным. Хотя впоследствии выяснилось, что азот, наоборот, крайне необходим для всех живых существ, название сохранилось во французском и русском языках.
Возможно, слово «азот» произошло от одного из двух арабских слов — либо от слова «аззат» («сущность» или «внутренняя реальность»), либо от слова «зибак» («ртуть»).
На латыни азот называется «nitrogenium», то есть «рождающий селитру»; английское название производится от латинского. В немецком языке используется название Stickstoff, что означает «удушающее вещество».
Азот в природе
Изотопы
Природный азот состоит из двух стабильных изотопов 14N — 99,635 % и 15N — 0,365 %.
Искусственно получены четырнадцать радиоактивных изотопов азота с массовыми числами от 10 до 13 и от 16 до 25. Все они являются очень короткоживущими изотопами. Самый стабильный из них 13N имеет период полураспада примерно 10 мин. Некоторые из изотопов азота приведены в Приложении 1.
Приложение 1. Характеристика некоторых изотопов азота.
| Стабильные | Радиоактивные | Содержание в ядре, в % | Атомная масса по отношению к O2 | Период полураспада | Тип превращения |
| - | N12 | - | 12,0228 | 0,0125 сек. | β+ |
| - | N13 | - | 13,0099 | 9,93 мин. | β+ |
| N14 | - | 99,635 | 14,007530 | - | - |
| N15 | - | 0,365 | 15,004870 | - | - |
| - | N16 | - | 16,0111 | 7,35 сек. | β+, λ |
| - | N17 | - | 17,0138 | 7,35 сек. | β-, η |
Распространённость
Вне пределов Земли азот обнаружен в газовых туманностях, солнечной атмосфере, на Уране, Нептуне, межзвёздном пространстве и др. Азот — четвёртый по распространённости элемент Солнечной системы (после водорода, гелия и кислорода).
Азот, в форме двухатомных молекул N2 составляет большую часть атмосферы, где его содержание составляет 75,6 % (по массе) или 78,084 % (по объёму).
Биологическая роль
Азот является элементом, необходимым для существования животных и растений, он входит в состав белков (16—18 % по массе), аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др. В составе живых клеток по массовой доле — около 2,5 %. В связи с этим значительное количество связанного азота содержится в живых организмах, «мёртвой органике» и дисперсном веществе морей и океанов. В результате процессов гниения и разложения азотсодержащей органики, при условии благоприятных факторов окружающей среды, могут образоваться природные залежи полезных ископаемых, содержащие азот, например: KNO3 (селитра) и NaNО3 (чилийская селитра). Оба широко распространены, обычно в малых количествах, в виде солевых отложений в засушливых областях и в виде выветриваний на почвах и в пещерах.
Токсикология азота и его соединений
Сам по себе атмосферный азот достаточно инертен, чтобы оказывать непосредственное влияние на организм человека и млекопитающих. Тем не менее, при повышенном давлении он вызывает наркоз, опьянение или удушье; при быстром снижении давления азот вызывает кессонную болезнь.
Многие соединения азота очень активны и нередко токсичны.
Химические свойства, строение молекулы
Азот в свободном состоянии существует в форме двухатомных молекул N2: N≡N (длина связи N≡N = 0,1095 нм). Вследствие этого молекула азота крайне прочна, для реакции диссоциации N2 ↔ 2N: ΔH°298=945 кДж/моль, константа скорости реакции К298=10−120, то есть диссоциация молекул азота при нормальных условиях практически не происходит (равновесие практически полностью сдвинуто влево). Молекула азота неполярна и слабо поляризуется, силы взаимодействия между молекулами очень слабые, поэтому в обычных условиях азот газообразен.
Даже при 3000 °C степень термической диссоциации N2 составляет всего 0,1 %, и лишь при температуре около 5000 °C достигает нескольких процентов (при нормальном давлении). В высоких слоях атмосферы происходит фотохимическая диссоциация молекул N2. В лабораторных условиях можно получить атомарный азот, пропуская газообразный N2 при сильном разряжении через поле высокочастотного электрического разряда. Атомарный азот намного активнее молекулярного: в частности, при обычной температуре он реагирует с серой, фосфором, мышьяком и с рядом металлов.
Оксиды азота
Азот — единственный элемент, образующий по меньшей мере девять молекулярных оксидов(см. приложение 2), три из которых парамагнитны; все оксиды термодинамически неустойчивы по отношению к разложению на N2 и О2.
В отличие от других элементов VА группы, азот образует большое число оксидов: N2О, NO, N2О3, NО2, N2О4, N2О5, а также неустойчивые N4О и NО3. Энтальпии образования оксидов азота ΔHf° > 0. Реакции образования оксидов из простых веществ сопровождаются уменьшением числа молей газов, а значит, уменьшением энтропии (ΔSf° < 0). Таким образом, стандартная энергия Гиббса оказывается положительной, т.е. при стандартных условиях ни один оксид азота не может быть получен из простых веществ. В стандартных условиях оксиды азота термодинамически неустойчивы к распаду на простые вещества. Однако при температурах ниже 700 °С реакции разложения оксидов азота кинетически заторможены.
Приложение 2. Виды и строение оксидов азота.
| Формула | Название | Строение | Описание |
| N2O | Монооксид диазота | 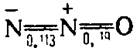 | Бесцветный газ |
| NO | Монооксид азота | 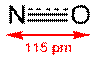 | Бесцветный парамагнитный газ |
| N2O3 | Триоксид диазота | 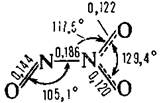 | Голубое твердое вещество |
| NO2 | Диоксид азота | 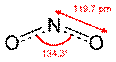 | Коричневый парамагнитный газ |
| N2O4 | Тетраоксид диазота | 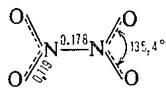 | Бесцветная жидкость |
| N2O5 | Пентаоксид диазота | 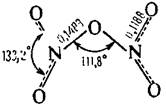 | Бесцветное ионное твердое вещество |
| NO3 | Триоксид азота | 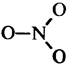 | Неустойчивый парамагнитный радикал |
| N4O | Нитрозилазид | 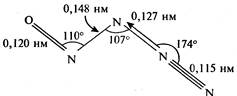 | Бледно-желтое твердое вещество. |
| N(NO2)3 | Тринитрамид | 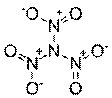 | Открыто в 2010 году в Швеции. |
Оксонитрид азота (I) (оксид диазота, закись азота, веселящий газ) — соединение с химической формулой N2O. При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом. Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта.
Получение
Закись азота получают нагреванием сухого нитрата аммония. Разложение начинается при 170 °C и сопровождается выделением тепла. Поэтому, чтобы не дать протекать ему слишком бурно, следует вовремя прекратить нагревание, так как при температурах более 300 °C нитрат аммония разлагается со взрывом:
NH4NO3 → N2O↑ + 2H2O.
Более удобным способом является нагревание сульфаминовой кислоты с 73%-й азотной кислотой:
NH2SO2OH + HNO3 (73 %) → N2O↑ + H2SO4 + H2O.
Другие методы получения заключаются в восстановлении водных растворов азотной кислоты гидроксиламином или азидом водорода:
HNО2 + NH2OH → N2О↑ + 2H2О.
HNО2 + HN2 → N2О↑ + N2↑ + H2О.
Используется также термическое разложение нитрамида H2NNО2 или азотноватистой кислоты H2N2О2 (оба эти вещества имеют эмпирическую формулу N2О • Н2О). Хотя N2О может быть получен таким способом, он не считается ангидридом азотноватистой кислоты, так как H2N2О2 не образуется при растворении N2О в Н2О (подобным образом соотносятся СО и муравьиная кислота).
N2O относится к несолеобразующим оксидам. В нормальных условиях N2O химически инертен, при нагревании проявляет свойства окислителя:
N2O + H2 → N2↑ + H2O.
N2O + C → N2↑ + CO↑.
При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя:
5N2О + 8KMnO4 + 7H2SO4 → 5Mn(NO3)2 + 3MnSO4 + 4K2SO4 + 7H2O.
С водой, с растворами щелочей и кислот не взаимодействует.
N2О термодинамически неустойчив, при нагревании выше 600 °С диссоциирует за счет расщепления более слабой связи:
2N2O → 2N2↑ + O2↑.
Энергия активации этого процесса высокая (~250 кДж/моль), и при комнатной температуре N2О относительно инертен, например, он не реагирует с галогенами, щелочными металлами и даже озоном. При более высоких температурах реакционная способность заметно возрастает: взаимодействие с Н2 дает N2 и Н2О; многие другие неметаллы реагируют с образованием оксидов, газ поддерживает горение. Вероятно, наиболее важная реакция — взаимодействие с расплавами амидов щелочных металлов с образованием азидов; реакция с NaNH2 служит промышленным способом получения NaN3 и, следовательно, и всех других азидов:
NaNH2 + N2О → (200°С) NaN3 + H2О↑.
NaNH2 + H2О → NaOH + NH3↑.
Следует также отметить, что N2О (подобно N2) может выступать в роли лиганда, вытесняя Н2О из аквакомплекса [Ru(NH3)5(H2О)]2+:
[Ru(NH3)5(H2О)]2+ + N2О → [Ru(NH3)5(N2О)]2+ + H2О.
Применение
Используется в основном как средство для ингаляционного наркоза, в основном в сочетании с другими препаратами (из-за недостаточно сильного обезболивающего действия). В то же время это соединение можно назвать самым безопасным средством для наркоза, так как после его применения почти не бывает осложнений. Также иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. В смеси с эфиром, циклопропаном, хлорэтилом в определённых концентрациях взрывоопасен.
Средство для ингаляционного наркоза
Малые концентрации закиси азота вызывают чувство опьянения и лёгкую сонливость. При вдыхании чистого газа быстро развиваются состояние наркотического опьянения, а затем асфиксия. В смеси с кислородом при правильном дозировании вызывает наркоз без предварительного возбуждения и побочных явлений. Закись азота обладает слабой наркотической активностью, в связи с чем её необходимо применять в больших концентрациях. В большинстве случаев применяют комбинированный наркоз, при котором закись азота сочетают с другими, более мощными, средствами для наркоза.
Закись азота не вызывает раздражения дыхательных путей. Будучи, в процессе вдыхания, растворенной в плазме крови, практически не изменяется и не метаболизируется, с гемоглобином не связывается. После прекращения вдыхания выделяется (в течение 10—15 мин) через дыхательные пути в неизменном виде.
Лечебный наркоз закисью азота (при стенокардии и инфаркте миокарда) противопоказан при тяжёлых заболеваниях нервной системы, хроническом алкоголизме, состоянии алкогольного опьянения (возможны возбуждение, галлюцинации).
В двигателях внутреннего сгорания
Закись азота иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. В случае автомобильных применений вещество, содержащее закись азота, и горючее впрыскиваются во впускной (всасывающий) коллектор двигателя, что приводит к следующим результатам:
· снижает температуру всасываемого в двигатель воздуха, обеспечивая плотный поступающий заряд смеси.
· увеличивает содержание кислорода в поступающем заряде (воздух содержит 21% кислорода).
· повышает скорость (интенсивность) сгорания в цилиндрах двигателя.
В пищевой промышленности
Следует отметить, что несмотря на своеобразную и интересную химию N2O, основное промышленное применение вещество нашло в качестве пропеллента(E942) и разрыхлителя для взбитого мороженого — это связано со способностью растворяться под давлением в растительных жирах вместе с нетоксичностью в малых концентрациях и отсутствием вкуса.
Оксид азота (II) (мон(о)оксид азота, окись азота, нитрозил-радикал) NO — несолеобразующий оксид азота. В нормальных условиях он представляет собой бесцветный газ, плохо растворимый в воде.
Наличие неспаренного электрона обусловливает склонность NO к образованию слабосвязанных димеров N2O2. Это непрочные соединения с ΔH° димеризации = 17 кДж. Жидкий оксид азота (II) на 25 % состоит из молекул N2O2, а твердый оксид целиком состоит из них.
Присутствие дополнительного электрона обусловливает очень низкую энергию ионизации молекулы (9,25 эВ; ср. с 15,6 эВ для N2, 14,0 эВ для СО и 12,1 эВ для 02). Низкая склонность к димеризации может быть связана как с пространственным распределением неспаренного электрона по всей молекуле, так и с тем фактом, что димеризация с образованием 0=N-N=O оставляет неизменным суммарный порядок связи (2 х 2,5 = 5). При переходе NO в жидкое состояние происходит частичная димеризация, причем цис-форма намного устойчивей, чем транс-форма. Чистая жидкость бесцветная, а не голубая, как иногда указывают в литературе: голубая окраска некоторых образцов обусловлена примесью интенсивно окрашенного N2О3. Чистый кристаллический оксид азота также бесцветный.
Наиболее вероятно, что димер имеет цис-структуру, а не прямоугольную структуру, которую одно время считали более предпочтительной:
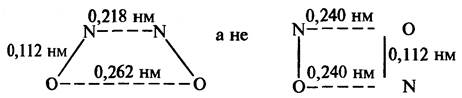
Недавно был описан асимметричный димер. Он образуется в виде красных частиц при конденсации NO в присутствии полярных молекул, таких как НСl или SО2.
Получение
В лаборатории вещество синтезируют из водных растворов мягким восстановлением подкисленных нитритов с помощью иодида либо диспропорционированием азотной кислоты в присутствии разбавленной серной кислоты:
KNО2 + KI + H2SО4 → NO↑ + K2SО4 + H2O+ 1/2I2↓.
KNО2 + K4[Fe(CN)6] + 2MeCО2H → NO↑ + K3[Fe(CN)6] + H2О + 2MeCО2K.
6NaNО2 + 3H2SО4 → 4NO↑ + 2HNО3 + 2H2О + 3Na2SО4.
В лаборатории так же его можно получить взаимодействием 30%-ной HNO3 с некоторыми металлами, например, с медью:
3Cu + 8HNO3 (30 %) → 3Cu(NO3)2 + 2NO↑ + 4H2O.
Более чистый, не загрязнённый примесями NO получают иначе:
FeCl2 + NaNO2 + 2HCl → FeCl3 + NaCl + NO↑ + H2O.
2HNO2 + 2HI → 2NO↑ + I2↓ + 2H2O.
Оксид азота (II) — единственный из оксидов азота, который можно получить непосредственно из свободных элементов соединением азота с кислородом при высоких температурах (1200—1300 °C) или в электрическом разряде. В природе он образуется в атмосфере при грозовых разрядах:
N2 + O2 → 2NO↑ — 180,9 кДж.
и тотчас же реагирует с кислородом:
2NO + O2 → 2NO2↑.
Промышленный способ основан на окислении аммиака при высокой температуре и давлении при участии Pt, Cr2O3 (как катализаторов):
4NH3 + 5O2 → 4NO↑ + 6H2O.
Оксид азота — бесцветный мономерный парамагнитный газ с низкими температурами плавления и кипения. Он термодинамически неустойчив и разлагается на элементы при высоких температурах (1100-1200 °С), что препятствует прямому синтезу из N2 и О2. При высоких давлениях и умеренных температурах (~50 °С) быстро диспропорционирует:
3NO → N2О↑ + NО2↑.
Однако при поглощении газа цеолитом(водные алюмосиликаты кальция и натрия) диспропорционирование идет другим путем:
4NO → N2О↑ + N2О3↑.
Для NO характерны реакции присоединения галогенов с образованием нитрозилгалогенидов, в этой реакции NO проявляет свойства восстановителя:
2NO + Cl2 → 2NOCl (нитрозилхлорид).
В присутствии более сильных восстановителей NO проявляет окислительные свойства:
SО2 + 2NO → N2О↑ + SО3↑.
2H2SО3 + 2NO → 2H2SО3NO [-H2SO3] → H2SО3(NO)2 → N2О↑ + H2SО4.
В воде NO мало растворим и с ней не реагирует, являясь несолеобразующим оксидом.
Как и все оксиды азота (кроме N2O), NO — токсичен, при вдыхании поражает дыхательные пути.
Оксид азота считался токсичным газом и загрязняющим атмосферу веществом, пока в 1987 году не была выдана Нобелевская премия за доказательство его роли в физиологических процессах организма млекопитающих. С тех поры было выяснено, что оксид азота принимает участие в таких процессах, как обучение и запоминание, регуляция кровяного давления, мужская эрекция, пищеварение, борьба с инфекцией и раком. За два последних десятилетия было установлено, что молекула NO обладает широким спектром биологического действия, которое условно можно разделить на регуляторное, защитное и вредное. NO действует как посредник в передаче клеточных сигналов внутри клетки и между клетками. Оксид азота, производимый клетками эндотелия сосудов, отвечает за расслабление гладких мышц сосудов и их расширение. NO также обладает цитотоксическими и цитостатическими свойствами. Клетки-киллеры иммунной системы используют оксид азота для уничтожения бактерий и клеток злокачественных опухолей. С нарушением биосинтеза и метаболизма NO связаны такие заболевания, как эссенциальная артериальная гипертензия, ишемическая болезнь сердца, инфаркт миокарда, первичная легочная гипертензия, бронхиальная астма, невротическая депрессия, эпилепсия, нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона), сахарный диабет, импотенция и др.
В 1998 году Роберту Ферчготту, Луису Игнарро и Фериду Мураду была присуждена Нобелевская премия по физиологии и медицине «За открытие роли оксида азота как сигнальной молекулы в регуляции сердечно-сосудистой системы».
Применение
Оксид азота — простейшая известная термически устойчивая молекула с нечетным числом электронов, поэтому его электронная структура и химические свойства широко изучались. Оксид азота — промежуточное соединение в производстве азотной кислоты, в промышленности его получают каталитическим окислением аммиака.
При понижении температуры оксид азота(II) разлагается на азот и кислород, но если температура падает резко, то не успевший разложиться оксид существует достаточно долго: при низкой температуре скорость распада невелика. Такое резкое охлаждение называется «закалкой» и используется при одном из способов получения азотной кислоты.
Оксид азота (III) (азотистый ангидрид, сесквиоксид азота) N2O3 — жидкость синего цвета (при н. у.), бесцветный газ (при стандартных условиях), в твёрдом виде — синеватого цвета. Устойчив только при температурах ниже −4 °C. Без примесей NO2 и NO существует только в твёрдом виде.
Твердое вещество— бледно-голубое; жидкость — синего цвета при низких температурах, но цвет ослабевает и становится зеленоватым из-за присутствия NО2 при высоких температурах.
Структурные данные были получены из микроволнового спектра газа при низких температурах. Примечательна длинная (слабая) связь N-N (ср. с 0,145 нм для гидразина). Этим N2О3 напоминает N2О4.
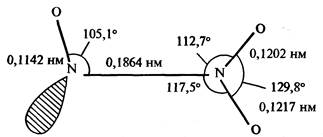
Получение
Чистый N2О3 может быть получен только при низких температурах, потому что выше точки плавления (-100,1 °С) он диссоциирует все в большей степени в соответствии с равновесием:
N2О3 (Синий) ↔ NO (бесцветный) + NО2 (коричневый).
2NO2 (Коричневый) ↔ N2О4 (бесцветный).
Альтернативные методы получения включают восстановление азотной кислоты (1:1) с помощью As203 при 70 °С или восстановление дымящей HN03 диоксидом серы с последующим гидролизом:
2HNО3 + 2H2О + As2О3 → N2О3 + 2H3AsО4.
2HNО3 + 2SО2 → 2NOHSО4[+H2O] → N2О3 + 2H2SО4.
Однако эти методы на выходе не дают абсолютно безводный продукт, а дегидратация может оказаться затруднительной. Изучение химических свойств N2О3 осложняется его диссоциацией на NO и NО2, которые сами по себе весьма реакционноспособные соединения.
Также N2O3 можно получить действием 50%-ой азотной кислоты на крахмал:
(С6H10O5)n + 12nHNO3(50%) → 6nNO↑ + 6nNO2↑ + 6nCO2↑ + 11nH2O.
При пропускании электрического разряда через жидкий воздух N2O3 можно получить в виде порошка голубого цвета:
N2 + O2 → 2NO.
2NO + O2 → 2NO2..
NO + NO2 → N2O3.
С водой N2О3 реагирует как ангидрид азотистой кислоты:
N2О3 + H2О → 2HNО2.
Являясь азотистым ангидридом, при взаимодействии с водой N2O3 даёт азотистую кислоту:
N2O3 + H2O ↔ 2HNO2.
При взаимодействии с растворами щелочей образуются соответствующие нитриты:
N2O3 + 2KOH → 2KNO2 + H2O.
Применение
Применяется в лаборатории для получения азотистой кислоты и её солей.
Высоко токсичен. По действию на организм сравним с дымящей азотной кислотой. Вызывает тяжёлые ожоги кожи.
Оксид азота (IV) (диоксид азота, бурый газ) NO2 — газ, красно-бурого цвета, с характерным острым запахом или желтоватая жидкость.
Быстро устанавливающееся равновесие N2О4 ↔ 2NО2 делает невозможным изучение чистых индивидуальных соединений в интервале температур от -10 °С до +140 °С, хотя молекулярные свойства каждого соединения в равновесной смеси часто можно определить. При всех температурах ниже температуры замерзания (-11,2 °С) твердое вещество состоит полностью из молекул N2О4, а жидкость при этой температуре содержит 0,01% NО2. При температуре кипения (21,5 °С) жидкость содержит 0,1% NО2, но газ более активно диссоциирует и содержит 15,9% NО2 при этой температуре и 99% NО2 при 135 °С. Увеличение степени диссоциации легко проследить по усилению коричневого цвета благодаря присутствию NО2.
Неспаренный электрон в NО2 в большей степени локализован на атоме N, чем в молекуле NO, и этим можно объяснить легкую димеризацию.
Получение
Лучший способ получения N2О4— термическое разложение абсолютно сухого Pb(NО3)2 с последующей конденсацией выделяющихся газов и фракционной дистилляцией:
2Pb(NО3)2 → (примерно 400 градусов) 4NО2↑ + 2PbO + О2↑.
В лаборатории NO2 обычно получают воздействием концентрированной азотной кислотой на медь:
Cu + 4HNO3 (конц.) → Cu(NO3)2 + 2NO2↑ + 2H2O.
Другие методы (более сложные или дорогостоящие) включают реакцию азотной кислоты с SО2 или Р4О10 и реакцию нитрозилхлорида с AgNО3:
2HNО3 + SО2 → N2О4 + H2SО4.
4HNO3 + P4O10 → 2N2О4 + О2↑ + 4HPО3.
NOCl + AgNО3 → N2О4 + AgCl.
Соединение также образуется при взаимодействии NO с кислородом:
2NO + О2 ↔2NО2 ↔ N2О4(охлаждение →; нагревание ←)
Кислотный оксид, ему соответствуют азотная и азотистая кислоты. NO2 отличается высокой химической активностью. Он взаимодействует с неметаллами (фосфор, сера и углерод горят в нём). В этих реакциях NO2 — окислитель:
2NO2 + 2C → 2CO2↑ + N2↑.
10NO2 + 8P → 4P2O5 + 5N2↑ (10NO2 + 2P4 → 2P4O10 + 5N2↑).
Окисляет SO2 в SO3 — на этой реакции основан нитрозный метод получения серной кислоты:
SO2 + NO2 → SO3 + NO↑.
Так же окислительное действие NO2 иллюстрируется следующими примерами:
NО2 + 2HC1 → NОC1 + Н2О + 1/2Сl2.
NО2 + 2HHal → (to)NO + H2О + Hal2 (Hal = Сl,Вr).
2NО2 + F2 →2FNО2.
NО2 + CO → NO + CО2.
С водой N2O4/NO2 образуют азотную кислоту, поэтому влажные газы высоко коррозионные:
N2О4 + H2О ↔ HNО3 + HNО2.
3HNО2 → HNО3 + 2NO + H2О.
Если растворение проводить в избытке кислорода, образуется только азотная кислота (NO2 проявляет свойства восстановителя):
4NO2 + 2H2O + O2 ↔ 4HNO3.
При растворении NO2 в щелочах образуются как нитраты, так и нитриты:
2NO2 + 2KOH → KNO3 + KNO2 + H2O.
Жидкий NO2 применяется для получения безводных нитратов:
Zn + 2N2O4 → Zn(NO3)2 + 2NO.
Применение
N2О4 широко изучался как неводный растворитель, соединение крайне полезно для приготовления безводных нитратов металлов и нитратных комплексов. Большая часть химических реакций может быть объяснена с точки зрения равновесия автоионизации, похожего на равновесие для жидкого аммиака:
N2О4 (Растворитель) = NO+ (сольво-кислота) + NO3- (сольво-основание)
Используется в производстве серной и азотной кислот, в смесях взрывчатых веществах.
N2О4 также широко использовался как окислитель для основанного на гидразине топлива в космических устройствах. К примеру, опускающиеся на Луну управляемые человеком модули «Аполлон» (1969— 1972 гг.) использовали 5 т жидкого N2О4 во время посадки на поверхность Луны и 1,5 т во время обратного подъема. Топливо представляло собой смесь MeNHNH2 и Me2NNH2 в соотношении 1: 1.
Оксид азота (IV) высокотоксичен. Даже в небольших концентрациях он раздражает дыхательные пути, в больших концентрациях вызывает отёк лёгких.
«Лисий хвост»
«Лисий хвост» — жаргонное название выбросов в атмосферу оксидов азота на химических предприятиях (иногда — из выхлопных труб автомобилей).
Название
Название происходит от оранжево-бурого цвета диоксида азота. При низких температурах диоксид азота димеризуется и становится бесцветным. В летний сезон «лисьи хвосты» наиболее заметны, так как в выбросах возрастает концентрация мономерной формы.
Оксид азота (V) (пентаоксид диазота, нитрат нитроила, азотный ангидрид) N2O5 — бесцветные, очень летучие кристаллы. Крайне неустойчив.
Получение
Его получают в виде высокореакционноспособного, расплывающегося, светочувствительного, бесцветного твердого кристаллического вещества путем осторожной дегидратации концентрированной азотной кислоты:
4HNO3 + P4O10 → (-10 oC) 2N205 + 4HP03.
Пропуская сухой хлор над сухим нитратом серебра:
4AgNO3 + 2Cl2 → 4AgCl + 2N2O5 + O2↑.
Путём взаимодействия оксида азота(IV) с озоном:
2NO2 + O3 → N2O5 + O2↑.
Химические свойства
Рентгеноструктурные исследования показывают, что твердый N2O5 состоит из ионов: линейных NО2+ (N-0 0,1154 нм) и плоских NO3- (N-O 0,124 нм). В газовой фазе и в растворах (в СС14, СНС13, РОС13) соединение существует в виде молекул; его структура до конца не изучена, но можно предположить строение О2N-О-NО2 с центральным углом N-О-N, близким к 180°. Молекулярная форма может быть получена также при быстром замораживании газа до -180 °С, но она быстро возвращается в более устойчивую ионную форму, как только нагревается до -70 °С.
N2О5 легко гидратируется до азотной кислоты и реагирует с Н2О2, давая надазотную кислоту в качестве сопутствующего продукта:
N2О5 + H2О → 2HONО2.
N2О5 + H2О2 → HONО2 + HOONО2.
Растворяется в щелочах с образованием нитратов:
N2O5 + 2NaOH → 2NaNO3 + H2O.
Он действует как сильный окислитель по отношению к большинству металлов, неметаллов и органических соединений:
N2О5 + Na → NaNО3 + NО2↑.
N2О5 + I2 → I2О5 + N2↑.
B газовой фазе N205 разлагается по реакции первого порядка, что можно объяснить диссоциативным равновесием с последующей быстрой реакцией согласно такой схеме:
N2О5 →NО2 + {NО3} → NО2↑ + О2↑ + NO↑.
N2О5 + NO ↔ 3NО2↑.
Триоксид азота N03
Существование трудноуловимой парамагнитной частицы {NО3} подразумевается также в некоторых других реакциях в газовой фазе с участием оксидов азота и в катализируемом N2О5 разложении озона; их концентрация достаточно высока, чтобы зарегистрировать спектр поглощения и подтвердить тем самым их присутствие как независимых химических частиц. В настоящее время такие реакции вызывают значительный интерес по экологическим причинам. Возможно, NО3 имеет симметричную плоскую структуру (подобно NO3-), но до сих пор она не выделена в виде чистого соединения.
Как и все оксиды азота (за исключением оксида азота(I) N2O), N2O5 токсичен. Работа с N2O5 требует осторожности, поскольку в стандартных условиях реакция может протекать достаточно быстро с большим выделением газообразных веществ. Кроме того, при разложении он даёт ядовитый NO2.
Нитрозилазид (N4O)
Внешний вид: бледно-желтое вещество. Брутто-формула: N4O. Формула в виде текста: NON3. Молекулярная масса (в а.е.м.): 72,026. Температура плавления: -57 оС. Температура разложения: -50. Выделен в 1993 г.
N4O →(to) N2O↑ + 2N2↑.
Тринитрамид {O=N(=O)N(N(=O)=O)N(=O)=O}
Тринитрамид — химическое вещество, открытое группой учёных Королевского технологического института (Швеция) в 2010 году. Молекула тринитрамида выражается формулой N(NO2)3. Это всего лишь девятое по счёту соединение азота и кислорода, известное науке.
Согласно первоначальным оценкам тринитрамид является перспективным кандидатом на роль высокоэффективного ракетного топлива. Результаты исследований показывают, что тринитрамидное топливо может быть на 20—30 % более эффективным, чем известные ранее. Однако на данный момент неизвестно, является ли устойчивой твёрдая фаза вещества.
Открытие произошло случайно в ходе компьютерного анализа процесса расщепления одной из сложных виртуальных топливных смесей. Кроме того, она – самая «тяжелая» из имеющихся восьми представителей семейства оксидов азота и имеет необычную форму пропеллера.
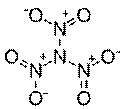
"На практике, при увеличении эффективности ракетного топлива на 10%, грузоподъемность ракеты может удвоиться. Более того, открытая молекула содержит только азот и кислород, что сделает топливо экологически чистым. Чего не скажешь о современном твердом топливе, при использовании которого выделяется эквивалент 550 тонн концентрированной соляной кислоты при каждом запуске космического шаттла"(Торе Бринк, профессор физической химии).
Вывод
Три оксида (N2О, NO и NО2) были известны уже 200 лет назад и практически стали первыми выделенными и идентифицированными газообразными соединениями (Дж. Пристли и др. в 1770-х гг.). Физиологическое действие N2O (веселящий газ, анестетик) и NO2 (раздражающий, едкий дым) было известно с древнейших времен, а проблема защиты от «NOx», выделяющихся из выхлопных труб автомобилей и являющихся компонентами фотохимического смога, хорошо знакома всем индустриальным странам. В настоящее время признана ключевая роль NO в передаче нервных сигналов в организме человека и животных, его биологически регулируемый синтез связан с функционированием сердечно-сосудистой и иммунной систем, а также имеет отношение к проблемам гипертонии, импотенции и др. Оксиды NO и NО2 необходимы для промышленного производства азотной кислоты и азотных удобрений, a N2О4 широко используется в качестве окислителя в ракетном топливе для космических полетов. Оксиды азота сыграли важную роль в доказательстве закона кратных отношений Дальтона, который привел к появлению атомистической теории (1803— 1808 гг.), но они все еще оставляют некоторые нерешенные вопросы в теории химической связи.
Литература
1) Гринвуд, Н. Н. Химия элементов [Текст]. В 2 т. Т. 1. Химия элементов / Н.Н. Гринвуд, А. Эрншо.-607 с.
2) Кнунянц, И.Л. Химическая энциклопедия: энциклопедия/ И.Л. Кнунянц, Н.С. Зефиров и др. – М.: «Советская энциклопедия», 1988. – 625с.
3) Википедия, режим доступа – онлайн: http://ru.wikipedia.org/wiki/Оксиды_азота
 2015-08-13
2015-08-13 1355
1355






