Оглавление
1. Оглавление_____________________________________________________________2
2. Диаграмма Пурбе для системы алюминий-вода_______________________________3
3. Литература______________________________________________________________9
Введение
Диаграмма Пурбе (диаграмма преобладающих форм, E-pH диаграмма) — диаграмма, наглядно отображающая термодинамически устойчивые формы существования элементов (ионов, молекул, атомных кристаллов и металлов) в растворах при различных значениях водородного показателя pH и окислительно-восстановительного потенциала E. Предложена Марселем Пурбе.
Для каждого элемента можно построить свою диаграмму Пурбе. Для одного элемента могут отличаться в зависимости от температуры, растворителя и присутствия лигандов в растворе. Однако как правило приводятся диаграммы Пурбе для водных растворов при 25оС. Диаграммы Пурбе строятся на основании уравнения Нернста и стандартных окислительно-восстановительных потенциалов.
Диаграмма Пурбе — мощнейшее средство предсказания направления химических реакций соединений данного элемента. Из неё можно определить условия большинства кислотно-основных и окислительно-восстановительных реакций соединений данного элемента без учета взаимодействия с посторонними ионами. По ней можно предсказать процессы диспропорционирования и конпропорционирования разных форм, возможность выделения ими водорода и кислорода. Сопоставляя диаграммы Пурбе для двух элементов можно предсказать окислительно-восстановительные реакции между их соединениями. Таким образом, диаграмма Пурбе для некоего элемента в сжатой форме отображает его неорганическую химию.
Диаграмма Пурбе строится в координатах E (ордината) — pH (абсцисса). Она отражает формы, которые термодинамически устойчивы при данном значении рН и окислительно-восстановительного потенциала среды. При меньшем потенциале соответствующая форма может быть восстановлена до нижележащей (если таковая существует), при более высоком — окислена до вышележащей (если таковая существует). Границы между формами существования раствор-твёрдое или раствор-газ обычно зависят от концентрации растворенных форм; границы между формами существования растворённых форм от их концентрации, как правило, не зависят.
Диаграмма Пурбе для системы алюминий-вода
С термодинамических позиций алюминий представляет собой достаточно активный в коррозионном отношении металл. В качестве подтверждения обычно приводят величину стандартного электродного потенциала, т.е. значение равновесного обратимого потенциала при активности ионов алюминия, равной единице. Эта величина составляет —1,663 В относительно нормального водородного электрода. Поэтому в «ряду напряжений» алюминий располагается в более отрицательной области по отношению не только к таким металлам, как медь, хром и железо, но даже и к таким, как кадмий и цинк.
По значению стандартного потенциала, однако, можно судить лишь весьма приближенно об условиях электрохимического равновесия алюминия в воде. Более полную картину можно представить, используя метод построения диаграмм рН — электродный потенциал.
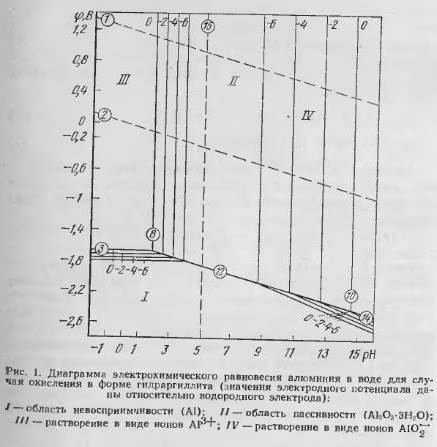
Вид диаграммы электрохимического равновесия, получившей также название диаграммы Пурбэ, приведен на рис. 1. На диаграмме можно отметить четыре характерные области. Расположение этих областей изменяется в зависимости от изменения состава продуктов электрохимических реакций.
На диаграмму наносятся также прямые линии, ограничивающие области электрохимического окисления воды по реакции:
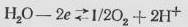 (1)
(1)
или электрохимического восстановления ее:
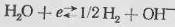 (2)
(2)
Из диаграммы следует, что при достаточно отрицательных значениях электродного потенциала алюминий не должен разрушаться в воде, т.е. он находится в области невосприимчивости в форме компактного металла. Однако это практически реализовать не удается в связи c тем, что в результате восстановления воды происходит повышение щелочности электролита и сдвиг в область растворения в виде алюминат-ионов.
Растворение компактного алюминия в кислых растворах протекает по реакции:
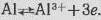
По этой реакции, зная значения энергии образования вещества ∆F (значения химических потенциалов), можно рассчитать равновесный электродный потенциал:
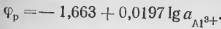 (3)
(3)
Эту же формулу можно получить из уравнения Нернста:
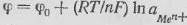 (4)
(4)
Выражение (3) определяет расположение на диаграмме горизонтальных линий, характеризующих растворение алюминия в кислых средах с образованием трехвалентного иона алюминия. Из этой формулы видно, что по мере растворения алюминия эти линии смещаются к более положительным значениям электродного потенциала, достигая при активности, равной единице, величины—1,663 В. Рассчитывая таким же образом электродные потенциалы выделения кислорода и водорода но реакциям (1) и (2), получаем уравнения, определяющие их зависимость от рН на диаграмме электрохимического равновесия:
 (5)
(5)
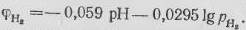 (6)
(6)
Переход из области растворения в виде трехвалентных ионов алюминия в пассивную область на диаграмме электрохимического равновесия соответствует образованию оксида алюминия из жидкой фазы.
Принято считать, что в обычных условиях в воде при температуре не выше 600С в пассивной области на поверхности алюминия образуется аморфный гидратированный оксид алюминия Al(ОН)3. При этих же температурах образуется также трехводный кристаллический оксид — байерит, имеющий моноклинную кристаллическую решетку. Многие исследователи считают, что в обычных условиях на алюминии образуется двухслойная пленка. Первый слой, толщина которого не превышает 10 нм, в основном содержит аморфный оксид алюминия. Верхний слон - композитный - состоит из байерита н бемита с орторомбической кристаллической решеткой. Толщина слоя зависит от характера среды, длительности выдержки и других факторов. При температурах 60-800С и выше на поверхности алюминия образуется одноводный оксид - бемит. Наконец, известна наиболее стабильная форма оксида - гидраргиллит - которая, так же как и байерит, является трехводной, но имеет другую кристаллическую решетку. Гидраргиллит практически не образуется на поверхности алюминия. Однако диаграммы электрохимического равновесия принято строить именно для этого оксида, а также для бемита.
Как видно из данных, приведенных в табл. 1, диаграммы для байерита и гидраргиллита не должны существенно различаться, поскольку оба оксида имеют близкие значении энергии образования.

Учитывая, что в воде при комнатной температуре на поверхности алюминия обычно формируется смесь байерита и аморфного оксида, а при повышенной — бемит, можно считать, что диаграмма, построенная для бемита, характеризует коррозионную стойкость в реальных водных средах. При этом оксид из жидкой фазы образуется по реакции:
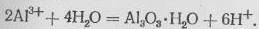 (7)
(7)
Рассчитанная для этой реакции формула имеет вид:
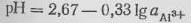 .
.
Из этой формулы следует, что при активности аAl3+=1 значение рН раствора, при котором происходит переход в пассивную область, равно 2,67. По мере снижения активности, т.е. по мере приближения к чаще встречающимся на практике случаям, граничное абсолютное значение водородного показателя возрастает. Для реальных атмосферных условий и для природных вод можно принять активность, близкую к 10-6. Тогда граничное значение водородного показателя будет составлять 4,67.
Для гидраргиллита граничные значения рН соответственно равны 2 и 4.
Растворение бемита в щелочной области определяетсяреакцией:
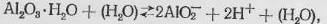 (9)
(9)
а расположение граничных ординат на диаграмме – уравнением:
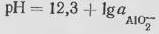 (10)
(10)
Следовательно, значения водородного показателя будут зависеть от активности: рН=12,3 при aAlO2-=1 и рН=6,3 при aAlO2-=10-6.
Для гидраргиллита значения водородного показателя несколько возрастает и при aAlO2-=1 и 10-6 равны соответственно 14,6 и 8,6.
В результате сопоставления расчетных значении с экспериментальными данными, полученными Г. В. Акимовым и А. Я. Шаталовым, можно сделать вывод, что диаграмма имеет большую сходимость с экспериментом, если принять значения активности для гидраргиллита, равными 10-6, а для бемита, равными 10-4.
В пассивной области бемит может образоваться при непосредственном окислении компактного алюминия:
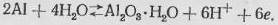 (11)
(11)
Расположение наклонной прямой, разделяющей области невосприимчивости и пассивности, определяется уравнением:
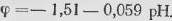 (12)
(12)
В щелочных средах алюминий, так же как и оксиды, растворяется с образованием алюминат-ионов:
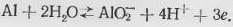 (13)
(13)
По этой реакции было рассчитано уравнение:
 (14)
(14)
Оно определяет расположение серии наклонных прямых на диаграмме при различных значениях активностей алюминат-ионов. Эти прямые разделяют области невосприимчивости и растворения в форме алюминатов.
На диаграмму можно также нанести вертикальную линию при рН=5,07, которая представляет границу сосуществования Al3+ и AlO2-. Расположение этой линии на диаграмме рассчитывают из условий подвижного равновесия:
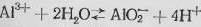 (15)
(15)
 (16)
(16)
Диаграммы электрохимического равновесия позволяют прежде всего установитьпринципиальные возможности получения устойчивого к коррозии состояния алюминиевых сплавов в простых водных средах. Они могут быть полезными при разработке оптимальных параметров некоторых процессов. Например, при использовании анодно-оксидных пленок для защиты алюминиевых изделий от коррозии последние подвергают обработке в горячей воде для того, чтобы в порах пленки более полно прошел процесс гидратации и соответственно закупорка пор. Операцию уплотнения проводят при погружении в чистую воду (обычно дистиллированную) при температуре около 1000C. Из диаграммы электрохимического равновесия следует, что водородный показатель этой воды принимают равным 5,07 с тем, чтобы получить максимальный защитный эффект от этой операции и избежать образования налета на поверхности.
Литература
1. Синявский В.С., Вальков В.Д., Калинин В.Д. «Коррозия и защита алюминиевых сплавов», 1986 г.
2. http://ru.wikipedia.org/Диаграмма_Пурбе
 2015-08-12
2015-08-12 6872
6872






