На первый взгляд кажется, что из данных по фрагментации молекул, происходящей при воздействии колоссального избытка энергии, можно только грубо оценивать их структуру. Однако разработанные логические обоснования корреляций между масс-спектром и структурой можно оценить как исключительно изящные, хотя иногда и произвольные.
Обычно стараются рассматривать молекулярный ион с локализованным зарядом. В приближении Будзикевича и соавторов (1967), положительный заряд локализован либо на π-связи (за исключением сопряженных систем), либо на гетероатоме.
Фрагментацию инициирует электронный удар, Только малая часть переносимой электронным пучком энергии расходуется на фрагментацию. Главная часть этой энергии переносится на структуру частицы и расходуется на возбуждение электронных и колебательных состояний катион-радикала.
Фрагментация молекулярного иона с нечетным числом электронов (катион-радикала М·+) по одинарной связи может происходить по гомолитическому или гетеролитическому пути. В случае гомолитического распада (схема 3, I) каждый электрон “движется” независимо, как показано стрелками типа рыболовного крючка (с полуострием): фрагментами являются катион с четным числом электронов и свободный радикал (с нечетным числом электронов). Во избежание загромождения формул достаточно изображать только одну из пары изогнутых стрелок (схема 3, II). При гетеролитическом распаде пара электронов “движется” в одном направлении к заряженному месту, как показано обычной изогнутой стрелкой; фрагментами также являются катион с четным числом электронов и радикал, но в данном случае положительный заряд находится на алкильном продукте (схема 3, III).
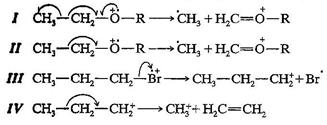
Схема 3.
В отсутствие колец (фрагментация которых требует разрыва двух или большего числа связей), бóльшая часть узнаваемых фрагментов в масс-спектре являются катионами с четным числом электронов, образованными, как было показано выше, при разрыве одинарных связей. Дальнейшая фрагментация такого катиона обычно приводит к другому катиону с четным числом электронов и нейтральной молекуле или фрагменту тоже с четным числом электронов (схема 3, IV).
Вероятность разрыва конкретной связи обусловлена ее прочностью, вероятностью переходов с низкой энергией и устойчивостью образовавшихся как заряженных, так и нейтральных фрагментов.
Используя общепринятые представления физической органической химии, можно сформулировать ряд общих правил для предсказания наиболее интенсивных пиков в спектре.
1. Относительная интенсивность пика молекулярного иона максимальна для неразветвленных соединений и уменьшается по мере увеличения разветвленности (см.правило 3).
2. С увеличением молекулярной массы в гомологическом ряду относительная интенсивность пика молекулярного иона обычно уменьшается. Исключением являются сложные эфиры жирных кислот.
3. Разрыв связей происходит преимущественно по алкилзамещенным атомам углерода. Чем больше степень замещения, тем вероятнее распад. Это является следствием повышения устойчивости третичного карбкатиона по сравнению с вторичным, который, в свою очередь, устойчивее первичного. Порядок устойчивости катионов: СН3+ < RCH2+ < R2CH+ < R3C+.
4. Двойные связи, циклические структуры и, особенно, ароматические (или гетероароматические) циклы стабилизируют молекулярный ион и, таким образом, увеличивают вероятность его появления.
5. Двойные связи способствуют аллильному распаду циклоалкенов с образованием аллильного карбокатиона.
6. Насыщенные циклы склонны терять боковые цепи при σ-связи. Это просто особый случай разветвления (правило 3). Положительный заряд остается на циклическом фрагменте (см. схему 4.).
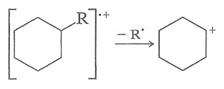
Схема 4.
7. Распад ароматических алкилзамещенных соединений наиболее вероятен по β-связи относительно цикла. В результате получается бензильный катион или, что более вероятно, катион тропилия (см.схему 5).
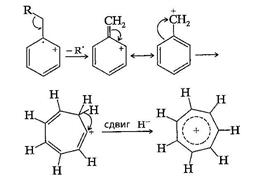
Схема 5.
Нужно иметь в виду, что представленные выше правила фрагментации применимы к масс-спектрам, которые получены с использованием электронного удара. Другие способы ионизации (например, химическая и др.) часто приводят к молекулярным ионам с гораздо более низкой энергией и их распад подчиняется другим правилам.
Список литературы
1. Казицына Л.А., Куплетская Н.Б. Применение УФ-, ИК- и ЯМР спектроскопии в органической химии. Учеб пособие для вузов. М.: Высшая школа. 1971. 264 с.
2. Преч Э., Бюльманн Ф., Аффольтер К. Методы в химии. Определение строения органических соединений. М.: Мир. БИНОМ. Лаборатория знаний. 2006. 439 с.
3. Свердлова О.В. Электронные спектры в органической химии. Л.:Химия. 1985. 248 с.
4. Сильверстейн Р., Вебстер Ф., Кимл Д. Методы в химии. Спектрофотометрическая идентификация органических соединений. М.: БИНОМ. Лаборатория знаний. 2011. 557 с.
 2015-10-14
2015-10-14 381
381






