1) Окислительная активность молекул галогенов уменьшится от фтора к йоду, т к с увеличением радиус атома способность галогена присоединять электроны уменьшаетсяю фтор-самый сильный окислитель,т к имеент наименьший радиус.
2)Hf-плавиковая кислота.слабость кислоты объясняется короткой длиной связи, тк у фтора очень маленький радиус. Чем меньше длина связи,тем трудней под действием диполей воды отщепляется водород. Энергия водородной связи между молекулами больше, чем между молекулами воды. Возникающая система водородных связей затрудняет гетеролитический распад hf.
3)В ряду кислот hcl-hbr-hi происходит усиление кислотных свойств.это можно объяснить тем, что сверху вниз в подгруппе галогенов с увеличением заряда ядра атома увеличиваются радиусы атомов. Поэтому связь между неметаллом, который образует кислоту, и водородом ослабляется.под действием диполей воды от молекулы hi легче всего отщепляется ион водорода. следовательно,она самая сильная в ряду.
4)В ряду hclo,hclo2,hclo3,hclo4 сила кислот усиливается.с ростом числа кислородных атомов и увеличение степени окисления хлора электронные облака все более стянуты к центральному атому h-o делается все более ионной.
5)В ряду h2s-h2se-h2te растет длина связи с водородом,а энергия уменьшается.сила кислот возрастает.
6)Для висмута +3,свинца+2,таллия+1
7)Уникальность углерода 300 млн соединений.объясняется тем,что он имеет 4 валентных электрона и 4 валентные орбитали и при этом наименьшие размеры р-облаков.это приводит к повышенной устойчивости sp3,sp2,sp-гибридных связей, а также пи связей.
8)h4sio4(ортокремниевая к-а),h2sio3(гель)кремниевые кис-тысоединения оксида кремния(iv)с водой,очень слабые кислоты.sio2(силикагель).кремниевая кис-та в воде практически нерастворима.в растворе выделяется в виде студенистого осадка.частично обезвоженная студенообразная кремниевая кис-та представляет собой твердую белую очень пористую массу,назыв.селикагелем.селикагель-представляет собой высушенный гель,образующийся из пересыщенных растворов кремниевых кислот.
9)амфотерность-способность элемента образовывать как катионные,так и анионные комплексы.примерами могут служить гидроокиси алюминия,цинка,хрома.
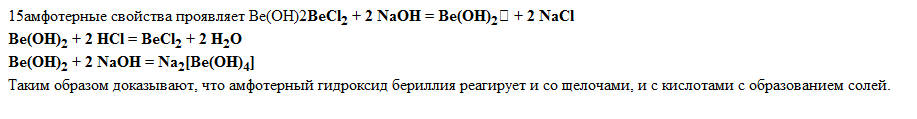
 2015-10-16
2015-10-16 727
727






