Моль
3. 37 г/моль
4. 74 г/моль
5. 2 моль
2. Оксидтің Na2O эквиваленті тең (моль):
1. 1 моль
2. 2 моль
Моль
4. 1/3 моль
5. 1/4 моль
3. Оксид SО3 эквивалентінің молярлық массасы тең (г/моль):
1. 26,67 г/моль
2. 80 г/моль
3. 5,33 г/моль
Г/моль
5. 16 г/моль
4. H3 PO4 + 2KOH = K2 HPO4 + 2H2 O теңдеу бойынша жүретiн реакцияда
фосфор қышқылының эквивалентi тең:
1. 1/3 моль/л
Моль/л
3. 1 моль
4. 33 г/моль
5. 49 г/моль
5. Оксидтің N2О5 эквиваленті тең (моль):
1. 1/2 моль
2. 1/5 моль
3. 1/7 моль
Моль
5. 2 моль
6. Оксидтің PbO2 (IV) эквиваленті тең (моль):
1. 1 моль
2. 1/2 моль
3. 2 моль
4. 1/3 моль
Моль
7. fэ =1/ n* В (n - металл атомдарының саны, В-металдың валенттiлiгi) формула бойынша
анықтайды
1. қышқылдың эквивалентiн
2. негiздiң эквивалентiн
3. тотықтырғыштың эквивалентiн
4. тотықсыздандырғыштың эквивалентiн
5. тұздың эквивалентiн
8. Күкірт қышқылының эквивалентінің молярлық массасы тең (г/моль):
1. 98 г/моль
2. 30 г/моль
Г/моль
4. 16 г/моль
5. дұрыс жоқ
9. Қышқылдың эквиваленті мына формула бойынша fэ = 1/n есептеледі, мұндағы «n» блдіреді
1. қышқыл түзуші – элемент атомының саны,
2. қышқылдың негізділігі
3. қышқыл қалдығының валенттілігі,
4. берген немесе қосып алған электрон саны
5. қышқыл молекуласындағы оттегі атом саны
10. fэ=1/n, (n- қышқылдың негiздiгi) формула бойынша анықтайды:.
1. қышқылдың эквивалентiн
2. тұздың эквивалентiн
3. негiздiң эквивалентiн
4. тотықтырғыштың эквивалентiн
5. тотықсыздандырғыштың эквивалентiн
11. NH3 қосылыстағы азоттың эквивалентi тең:
1. 1 моль
2. 3 моль
Моль
4. 17 моль
5. 14/3 моль
12. Зат эквивалентiнiң өлшем бiрлiгi:
1. моль/л
Моль
3. г/моль
4. г/мл
5. моль/кг
13. H3 PO4 + 2KOH = KH2PO4 + 2H2 O теңдеу бойынша жүретiн реакцияда
фосфор қышқылының эквивалентi тең:
1. 1/ 3 моль
2. 1/ 2 моль
Моль
4. 98 г/моль
5. 32,6 г/моль
14. H3 PO4 + 2KOH = K2 HPO4 + 2H2 O теңдеу бойынша жүретiн реакцияда
калий гидроксидінің эквивалентi тең:
1. / 3 моль
2. / 2 моль
Моль
4. 98 г/моль
5. 32,6 г/моль
15. Н2 СО3 + КОН = КНСО3 + Н2 О теңдеу бойынша жүретiн реакцияда көмiр
қышқылы эквивалентi тең:
1. 62 г/моль
2. 31 г/моль
Моль
4. 1/2 моль
5. 2 моль
16. Химиялық реакцияларда 1 моль сутектiң атомдарымен қосылатын немесе
1 моль атомдардың (иондардың) орнын басатын зат мөлшерiнiң атауы:
1. заттың молекуласы
2. заттың массасы
3. химиялық элемент
4. заттың химиялық эквивалентi
5. ерiтiндiнiң титрi
17. Элементтің химиялық эквиваленті тәуелді факторды көрсет.
1. температураға
2. атмосфералық қысымға
3. осмостық қысымға
4. қосылыстың валенттілігіне
5. катализатор қатысына
18. fэ = 1/n (n- гидроксид топтарының саны) формула бойынша анықтайды:
1. тұздың эквивалентiн
2. қышқылдық эквивалентiн
3. тотықтырғыштың эквивалентiн
4. тотықсыздандырғыштын эквивалентiн
5. негiздiң эквивалентiң
2. Ерітінділер концентрациясы
1. Молялдік концентрация дегеніміз – еріген заттың моль санының:
1. еріткіштің массасына қатынасы.
2. ерітіндінің массасына қатынасы
3.еріткіштің моль санына қатынасы.
4. еріткіштің көлеміне қатынасы
5. ерітіндінің көлеміне қатынасы
2. Зат эквивалентінің молярлық концентрациясының өлшем бірлігі:
1. моль
2. г/моль
Моль/л
4. г/мл
5. моль/кг
3. 1 мл/см3/ ерітіндіде неше грамм еріген зат барын көрсететін концентрацияның атауы:
1. ерітілген заттың массалық үлесі
Титр
3. проценттік концентрация
4. молярлық концентрация
5. эквиваленттің молярлық концентрациясы
4. Молярлық концентрация дегеніміз – еріген заттың моль санының:
1. еріткіштің көлеміне қатынасы.
2. ерітіндінің моль санына қатынасы
3. еріткіштің моль санына қатынасы
4. ерітіндінің көлеміне қатынасы
5. еріткіштің массасына қатынасы.
5. Молярлық концентрациясы белгiлi ерiтiндi дайындағанда, заттың
алынатын массасын есептеу үшiн қолданылатын формула:
1. m = CּMּV
2. m = m(ерітінді)ּ100%
3. m = 1000ּT
4. 
5. 
6. 5 г қант пен 45 г су араластырылды. Түзілген ерітіндідегі қанттың массалық үлесі:
1. 5%
2. 10%
3. 45%
4. 9%
5. 11,1%
7. 10 г тұз бен 40 г су араластырылды. Түзілген тұздың массалық үлесі:
1. 10%
2. 40%
3. 2,5%
4. 4%
5. 20%
8. 250 мл ерітіндіде 5 гр. НСІ бар. Осы ерітіндінің титрі тең:
Г/мл
2. 5 г/мл
3. 7,3 г/мл
4. 0,028 г/мл
5. 0,365 г/мл
9. 1 кг еріткіште неше грамм еріген зат барын көрсететін концентрация:
1. молярлық
2. пайыздық
3. эквивалентік
Моляльдік
5. титр
10.Еріген заттың артық мөлшерімен динамикалық тепе-теңдікте болатын ерітінді аталады:
1. буфер
2. изотоникалық
3. өте қаныққан
4. қанықпаған
5. қаныққан
11. 50 мл ерітіндіде 0,5 г азот қышқылы бар. Осы ерітіндінің титрі тең:
Г/мл
2. 2,00 г/мл
3. 0,63 г/мл
4. 1,26 г/мл
5. 0,0001 г/мл
12. Ерiген заттың массасы мен ерiтiндiнiң массасының қатынасымен көрсетедi:
1. ерiген заттың массалық үлесiн
2. заттың молярлық концентрациясын
3. эквиваленттiң молярлық концентрациясын
4. ерiтiндiнiң титрiн
5. ерiген заттың молярлық үлесiн
13. Ерiткiштiң мөлшерiмен салыстырғанда ерiтiлген зат ерiтiндiде аз мөлшерде болса, ерiтiндi:
1. концентрленген
2. қаныққан
3. буферлiк
4. изотоникалық
5. сұйылтылған
14. Заттың молярлық концентрациясының өлшем бірлігі:
1. г/моль
2.моль
3.г/мл
Моль/л
5.моль/кг
15. Бiр литр ерiтiндiде заттың неше моль эквивалентi барын көрсететiн концентрация:
1. ерiген заттың салыстырмалы үлесi
2. пайыздық
3. молярлық
Эквиваленттiк
5. титр
16. Эквиваленттік крнцентрация дегеніміз – бұл еріген заттың эквивалентінің моль санының:
1. ерітіндінің массасына қатынасы
2. ерітіндінің көлеміне қатынасы
3. еріткіштің моль санына қатынасы
4. еріткіштің массасына қатынасы
5. еріткіштің көлеміне қатынасы.
17. Ерітіндінің титрі анықталады:
1. ерітінді массасының еріген зат массасына қатынасы
2. 1 литр ерітіндідегі еріген заттың мөлшері
3. 1 литр ерітіндідегі еріген заттың эквивалент мөлшері
4. 1 мл ерітіндідегі еріген заттың грамм мөлшері
5. 1 кг еріткіштегі еріген заттың мөлшері
18. Күкірт қышқылының 200 мл ерітіндісінде 4,90 г Н2SO4 ерітілген. Н2SO4–нің эквивалентінің молярлық концентрациясы тең (моль/л):
Моль/л
2. 0,25 моль/л
3. 0,20 моль/л
4. 0,0005 моль/л
5. 0,00025 моль/л
19. 30 г қант пен 180 г су араластырылды. Түзілген ерітіндідегі қанттың массалық үлесі:
1.14%
2.20%
3.90%
4.9%
5.11.1%
20. Эквиваленті 0,2 натрий гидроксидінің массасы тең:
1.40г.
Г.
3.2.3г.
4.1.7г.
5. дұрыс жауап жоқ
21. Эквиваленті 0,01 азот қышқылының массасы тең:
1.63г.
Г.
3.1,4г.
4.21г.
5. дұрыс жауап жоқ
22. 100 мл ерітіндіде 4 г NaCl бар. Осы ерітіндінің титрі тең:
Г/мл
2.0,002 г/мл
3.50 г/мл
4. 0,585 г/мл
5. дұрыс жауап жоқ
23. 500 мл ерітіндіде 20 г натрий гидроксиді бар. Ерітіндінің титрі тең (г/мл):
Г/мл
2.2,50 г/мл
3.1 г/мл
4.0,8 г/мл
5. дұрыс жауап жоқ
24. 80 мл ерітіндіде 0,8 г азот қышқылы бар. Осы ерітіндінің титрі тең:
Г/мл
2.1 г/мл
3.0,63 г/м
4.1,26 г/мл
5. дұрыс жауап жоқ
25. 250 мл ерітіндіде 15 г хлорсутегі бар. Осы ерітіндінің титрі тең:
1.5 г/мл
Г/мл
3.7,3 г/мл
4.0,028 г/мл
5. дұрыс жауап жоқ
3. Химиялық термодинамика
1. Энтропияның өлшемі:
1. Дж
2.кДж
3.кДж/моль
Дж/ моль.К
5.моль/л.сек
2. Қасиеттері әртүрлі, жеке бөліктері көзге көрітнетін шекарамен бөлінген термодинамикалық жүйе:
1. аулақтанған
2.ашық
3.жабық
4.гомогенді
Гетерогенді
3. Бір-бірінен бөлінген, біртекті бөліктерінің химиялық және термодинамикалық қасиеттері бірдей, бір-біріне өткен кезде физикалық және химиялық қасиеттері шұғыл өзгеретін жүйе аталады:
1. параметр
2. энтропия
3. энтальпия
4. компонент
Фаза
4. Химиялық реакцияның жылу эффектісі бастапқы заттар мен өнімдердің табиғаттары мен күйлері тәуелді, реакцияның жылу жолына тәуелді емес. Бұл:
1. әрекеттесуші массалар заңы
2. термодинамиканың 2-ші бастамасы
3. Гесс заңы
4. Вант-Гофф заны
5. термодинамиканың 3-ші бастамасы
5. Тұрақты қысымда және тұрақты температурада жүретiн термодинамикалық процесс:
1. изобарлық
2. изотермиялық
3. изохорлық-изотермиялық
4. изобарлық-изотермиялық
5. адиабаттық
6. Термодинамикалық жүйенің күйін сипаттайтын параметрлар өзгергенде жүреді:
1. ішкі энергия
2. термодинамикалық процесс
3. термодинамика
4. термодинамикалық жүйе
5. ашық термодинамикалық жүйе
7. Заттың қандай күйінде энтропияның мәні жоғары болады:
1. сұйық
2. газ тәрізді
3. қатты
4. дұрыс кристалда температура абсолютті ноль
5. заттың энтропиясы тұрақты, агрегаттық күйге тәуелсіз
8. Зат сұйық күйден буға айналу фазалық процесстiң атауы:
1. балқу
2. кристалдану
3. конденсация
Булану
5. сұйылу
9. Өздiгiнен жүретiн химиялық реакцияларда Гиббс энергиясының өзгеруi:
1. оң шама
Терiс шама
3. өзгермейдi
4. дельта G =0, энтропия кемидi
5. дельта G >0, энтропия артады
10. Стандарт энтальпия мен Гибсс энергиясының өлшемі:
1. к/Дж, Дж.ккал, ккал
КДж/моль
3. ккал/моль, кал/моль
4. моль/ л.сек
5. моль/л
11. Жүйенің энтальпиясын арттыра жүретін химиялық реакция:
1. экзотермиялық
2. эндотермиялық
3. аналитикалық
4. каталитикалық
5. қайтымды
12. Толығымен жұмысқа айналмайтын жылу энергиясының бөлігі міндетті түрде қоршаған ортаны жылытуға кетеді. Бұл заң:
1. Д.И. Менделеевтің периодтық заңы
2. термодинамиканың бірінші заңы
3. термодинамиканың екінші заңы
4. әрекеттесуші массалар заңы
5. заттың құрамын сақтау заңы
13.Температураны арттырғанда эндотермиялық реакцияның жүру мүмкіндігі
1. азаяды
2. өзгермейді
Артады
4. нолге тең болады
5. ортаның рН-ына тәуелді
14. кДж/(моль.град) – қандай термодинамикалық параметр өлшем бірлігі
1. ішкі энергия
2. энтальпия
Энтропия
4. Гиббс энергиясы
5. дұрыс жауап жоқ
15. Қоршаған ортамен не энергия, не зат алмаспайтын термодинамикалық жүйе аталады
1. ашық
2. тірі ағза
3. жабық
4. оқшауланған
5. гомогенді
16. Жүйенің энтальпиясын кеміте жүретін химиялық реакция:
1. экзотермиялық
2. эндотермиялық
3. аналитикалық
4. каталитикалық
5. ферментативтік
17. Стандарт жағдайда I2 + H2 = 2HI реакцияның дельта G=37 кДж. Бұл реакция:
1. термодинамикалық тепе-теңдiк күйде
2. стандарт күйде
3. өздiгiнен жүредi
4. өздiгiнен жүрмейдi
5. дұрыс жауап берiлмеген
18. Химиялық реакцияның N2O4(г)= 2NO 2(г) нәтижесiнде энтропия (есептемей):
1. өседi
2. кемидi
3. өгермейдi
4. алдымен кемидi, одан кейiн артады
5. нолге тең болады
19. Химиялық реакцияның CaO (қ) + CO 2(г) = CaCО3(қ) нәтижесiнде энтропия:
1. өседi
Кемидi
3. өзгермейдi
4. нолге тең
5. алдымен өседi, одан кейiн кемидi
20. KNО3 кристалдарын суда ерiткенде KNO3(к) ---> K+(ер-ді) + NO3-(ер-ді),
заттың энтропиясы (есептемей):
Артады
2. кемидi
3. өзгермейдi
4. нольге тең
5. алдымен артады, одан кейiн кемидi
21. Математикалық өрнек дельта НХ.Р. = S дельта Нтүз.(өнім) - S дельта Нтүз.(бастапқы) сәйкес
1. Раульдің І заңы
2. Раульдің ІІ заңы
3. Раульдің ІІІ заңы
4. Гесс заңының І салдары
5. Вант-Гофф ережесі
22. Әртүрлі энергиялардың арасындағы байланыстарды реакциялардың жүру мүмкіндігі мен шегін, олардың бағытың анықтайтын ғылымның атауы:
Термодинамика
2. кинетика
3. аналитикалық химия
4. физикалық химия
5. коллоидтық химия
23. Жүйенің ішкі энергиясын арттыра, жылуды сіңіре жүретін реакция:
1. экзотермиялық
2. эндотермиялық
3. қайтымды
4. қайтымсыз
5. каталитикалық
24. Қоршаған ортамен энергия, зат алмасатын термодинамикалық жүйе аталады
1. оқшауланған
2. тірі ағза
3. жабық
4. ашық
5. гомогенді
25.Стандарт жағдайда жай заттардан 1 моль күрделi зат түзiлгенде бөлiнiп
шығатын немесе сiңiрiлетiн жылудың атауы:
1. ыдырау жылулығы
2. жанып бiту жылулығы
3. еру жылулығы
4. стандарт түзiлу жылулығы
5. сублимация
26. Стандарт жағдайда 1 моль күрделi зат жай заттарға ыдырағанда бөлiнiп
шығатын немесе сiңiрiлетiн жылудың атауы:
1. түзілу
2. еру
3. кристаллизация
Ыдырау
5. балқу
27. Стандарт жағдайда 1 моль күрделi зат жанғанда бөлiнiп
шығатын жылудың атауы:
1. түзілу
2. ыдырау
3. еру
Жану
5. балқу
28.Оқшауланған жүйеде өздігінен жүретін процестер:
1. жүйенің тәртіпсіздігі азаюы
2. энтропия азаюы
3. ерітіндінің рН-ы артуы
4. ерітіндінің рН-ы азаюы
Энтропия артуы
29. Термодинамикалық процеске энтропиялық және энтальпиялық факторлардың бір уақытта әсер етуі белгіленеді:
1. қысым
2. көлем
3. температура
Гиббс энергиясы
5. ішкі энергия
30. Температура кемуі арқылы эндотермиялық реакциялардың жүру мүмкіндігі:
Азаяды
2. өзгермейді
3. артады
4. нолге тең болады
5. рН-қа тәуелді
4. Химиялық реакция кинетикасы. Химичлық тепе-теңдік. Катализ.
1.Тепе-теңдiк күйдегi жүйенiң сыртқы жағдайларыны бiрiн өзгерткенде (Т, Р, С) тепе-теңдiк сол әсердi әлсiрететiн бағытта ығысады. Бұл:
1. заттардың массасы сақталу заңы
2. әсер етушi массалар заңы
3. энергия сақталу заңы
4. Гесс заңы
Ле Шателье принципi
2.Аз мөлшерлерi химиялық реакциялардың жылдамдығын өте кемiтетiн заттардың атауы:
Ингибиторлар
2. индикаторлар
3. ферменттер
4. катализаторлар
5. реттеушiлер
3. Өзінің табиғаты бойынша ферменттер (энзимдер) - бұл:
1. жай және күрделі көмірсулар
2. тек күрделі бейорганикалық қосылыстар
3. жай және күрделі бейорганикалық қосылыстар
4. арнайы жай және күрделі ақуыздар
5. тек жай ақуыздар
4. Химиялық тепе-теңдікте ұзақ тұрақты болатын жүйе:
1. қысым
2. температура
3. бастапқы заттар концентрациясы
4. өнім концентрациясы
5. температура, қысым және барлық заттар концентрациясы
5. Сұйық фазада жүретін реакцияның жылдамдығына әсер етпейді:
1. өнімдердің концентрациясы
2. температура
3. әрекеттесетін заттардың концентрациясы
4. катализатордың қатысуы
5. қысым
6. Егер катализатор және әректтесуші заттар әртүрлі фазада болса, онда катализ қалай аталады:
1. тәуелсіз
Гетерогенді
3. автокатализ
4. гомогенді
5. коллоидты
7. Белгілі температураға жеткенде ферментативті реакцияның жылдамдығы азаюы түсіндіріледі:
1. ферменттердің жоғары каталитикалқы активтілігі
2. ферменттердің жоғары селективтілігі
3. ферменттердің жылулық денатурациясы, яғни инактивациясы
4. ақуыздың амфотерлік қасиетімен
5. реакция жылдамдығының субстрат концентрациясына тәуелділігі
8. Жай реакцияға немесе элементар актке қатысатын молекулалар санының атауы:
1. реакция жылдамдығының константасы
2. реакция сатыларының саны
3. реакцияның реттілігі
4. реакцияның түрі
5.реакцияның молекулалығы
9. Әрекеттесетін заттар немесе өнімдердің молярлық концентрациясының уақыт бірлігіне өзгеруі аталады:
1. титрлеудің соңғы нүктесі
2. эквиваленттік нүкте
3. фазалық тепе-теңдік
4. химиялық реакцияның жылдамдығы
5. қайтымды реакция
10. Аррениустың теңдеуіндегі  шама А сиппатайды:
шама А сиппатайды:
1. актив қағысу үлесін
2. жүйенің температурасын
3. активтендіру энергиясын
4. заттың геометриялық структурасын
5. жүйенің ішкі энергиясын
11. Биохимиялық процестердің көбі үшін температуралық коэффициент тең:
1. 2-4
2. 273 –ке тең
3. 10-9-10-7 м
4. 7-9
5. 22,4л
12. СаО(к) + СО2(г) = СаСО3(к) теңдеу бойынша жүретiн реакция үшiн
тепе-теңдік константасының өрнегi:
1. 
2. 
3. 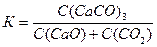
4. 
5. 5. К = С(СО2)
13. Ескі байланыстар толығымен үзілмей, ал жаңа байланыстар толық түзілмеген кездегі әрекеттесетін заттардың тұрақсыз күйі аталады:
1. Активтелген комплекс (өтпелі кезең)
2. комплексті қосылыстар
3. комплексон III
4. активтену энергиясы
5. химиялық тепе-теңдік
14. Екінші реттiк реакцияға сәйкес кинетикалық теңдеуi:
1.v=kС
2. v=к
3. v=kР
4. v=kСА.СВ
5. v=kC3
15. СаО(к) + СО2(г) = СаСО3(к) теңдеу бойынша жүретiн реакция үшiн
әсер етушi массалар заңының математикалық өрнегi:
1. 
2. 
3. 
4. 
5. 
16. Мерзім бірлігінде алынған заттардың қандай бөлігі реакцияға кіретінін көрсететін шаманың атауы:
1. эбулиоскопмялық константа
2. криоскопиялық константа
3. тепе-теңдік константасы
4.жылдамдық константасы
5. изотоникалық коэффициент
17. Бірнеше сатыланып жүретін реакциялардың түрі:
1. жай
2. күрделі
3.гомогенді
4.гетерогенді
5. баяу жүреді
18. Аяғына дейін, бастапқы заттар жойылғанша жүрмейтін реакциялар:
1. қайтымсыз
2.күрделі
3.жай
4.каталитикалық
5. қайтымды
19. Бір сатыда жүретін реакциялар:
Жай
2.күрделі
3.гомогенді
4.қайтымды
5.каталитикалық
20. Температураны әрбiр 10 градусқа жоғарлатқанда химиялық реакцияның жылдамдығы 2-4 есе өседi. Бұл:
1. Гесс заңы
2. Ле Шателье принципi
3. әсер етушi массалар заңы
Вант-Гофф ережесi
5. Гиббстың фазалар ережесi
5. Ерітінділердің коллигативтік қасиеттері
1. Еріткіштін шала өткізгіш мембрана арқылы концентрациясы кем ерітіндіден концентрациясы артық ерітіндіге қарай бір жақты өтуі:
1. коагуляция
Сірілену
3. буферлік әрекет
4. иондарға ыдырау
5. осмос
2. Бір кг. еріткіште 1 моль бейэлектролит еріткенде түзілген ерітіндінің қату температурасы неше градусқа төмендейтінін көрсетеді:
1. криометриялық константа
2. эбулиометриялық константа
3. изотоникалық коэффициент
4. тепе-теңдік константасы
5. жылдамдықтың константасы
3.Адам организмiнiң жеке органдары мен жасушаларын ұзақ уақыт сақтауға болады:
1. гипертоникалық ерiтiндiде
2. гипотоникалық ерiтiндiде
3. физиологиялық ерiтiндiде
4. кез келген буферлiк ерiтiндiде
5. кез келген күштi электролит ерiтiндiсiнде
4. Моляльдық концентрациялары тең ерiтiндiлерден ең жоғары температурада
қайнайтын ерiтiндi:
1. анилин
2. глюкоза
Кальций хлориді
4. сахароза
5. барлық ерітінділердің бірдей қайнау температулары бар
5. Хирургияда жараны микроорганизмдер және ыдырау өнімдерінен тазарту үшін қолданылады:
1. гипотоникалық ерітінділер
2.изотоникалық ерітінділер
3. физиологиялық ерітінділер
4. гипертоникалық ерітінділер
5. дұрыс жауап жоқ
6. Гипертоникалық ерiтiндiде қанның эритроциттерi бүрiсiп қалады.
Бұл құбылыстың атауы:
1. гемолиз
Плазмолиз
3. сiрiлену
4. катализ
5. коагуляция
7. Магний сульфаты мен натрий сульфаты үлкен дәрет қатқанда қолданылады:
1. гипотоникалық ерiтiндi түрiнде
2. изотоникалық ерiтiндi түрiнде
3. физиологиялық ерiтiндi түрiнде
4. гипертоникалық ертiнiдi түрiнде
5. буфер түрiнде
8. Молярлық концентрациялары тең болғандықтан, ерiтiндiлерi бiрдей
температурада қататың затардың қатары:
1. глицерин мен натрий сульфаты
2. натрий сульфаты мен глюкоза
Глицерин мен глюкоза
4. глюкоза мен калий гидроксидi
5. глюкоза мен калий сульфаты
9. Таза еріткішке қарағанда газдардың электролит ерітінділерінде еруі төмен. Бұл заң:
1. Генри
Сеченов
3. Вант-Гофф
4. Рауль
5. Менделеев
10.Бiрдей концентрацияда осмос қысымдары тең екi ерiтiндiнiң атауы:
1. буферлiк
2. гипотоникалық
3. гипертоникалық
4. изотоникалық
5. физиологиялық
11.Ерiтiндiнiң қату температурасының төмендеуiн өлшеуге негiзделген зерттеу әдiсiнiң атауы:
1. осмометрия
Криометрия
3. эмбулиометрия
4. изоосмия
5. рН-метрия
12.Гипотоникалық ерiтiнде қанның эритроциттерiнiң қабықшалары жарылып,
лак тәрiздес қан түзiледi. Бұл құбылыстың атауы:
Гемолиз
2. плазмолиз
3. желатиндеу
4. катализ
5. коагуляция
13.Адам организмiне көп мөлшерде еңгiзуге болады:
1. гипотоникалық ерiтiндiнi
2. гипертоникалық ерiтiнiдiнi
3. изотоникалық ерiтiндiнi
4. буферлiк ерiтiндiнi
5. қышқылдық ерiтiндiсiн
14. Эритроциттердің экзоосмосы әкеледі:
1. гемолизге
Плазмолизге
3. тургорге
4. желатиндеуге
5. коагуляцияға
15. Бiрдей температурада изотоникалық ерiтiндiлердi түзетiн тең
концентрациялы заттардың қатары:
1.ас тұзы, қант
2. глюкоза, азот қышқылы
3. калий гидроксидi, сiрке қышқылы
4.калий хлоридi, глицерин
5. глюкоза, қант, глицерин
16.Осмос қысымын өлшеуге негiзделген зерттеу әдiсiнiң атауы:
1.криометрия
2.эбулиометрия
3.изоосмия
Осмометрия
5. қышқылдық-негiздiк титрлеу
17.Қанның плазмасына изотоникалық ерiтiндiнiң атауы:
1. гипертоникалық
2. гипотоникалық
3. буферлiк
4. физиологиялық
5. каталитикалық
18.Еріткіштін криометриялық константасы тәуелді:
1. еріген заттың табиғатына
2. еріткіштің табиғатына
3. еріген заттың концентрациясына
4. ерітіндінің температурасына
5, еріген заттың табиғаты мен концентрациясына
19. Электролиттердің коллигативтік қасиеттерің сипаттайтын шамалар (Dp, Dt, т.б.) бейэлектролиттердікінен неше есе артық екенің көрсетеді:
1. изотоникалық коэффициент
2. криометриялық константа
3. эбулиометриялық константа
4. тепе-тендік константасы
5. сутектік көрсеткіш
20.Молекулалардың жылулық қозғалысы нәтижесiнде ерiтiндiдегi заттың
концентрациясы өздегiнен бiрдей болуы:
1. коагуляция
2. осмос
Диффузия
4. сiрiлену
5. концентрация
21.Молярлық концентрациялары тең екi әртүрлi бейэлектролиттер ерiтiндiлерiнiң:
1. молярлық массалары бiрдей
2. осмос қысымдары бiрдей
3. молекулаларының диффузия жылдамдықтары бiрдей
4. осмос қысымдары әртүрлi
5. изоэлектрлiк нүктелерi бiрдей
22. Стандарт ерітіндіде 0,02 моль/л глюкоза бар. Оған изотоникалық ерітіндіде глюкозаның концентрациясы болу керек:
1. 0,04 моль/л
2. 0,05 моль/л
3. 0,10 моль/л
Моль/л
5. 0,01 моль/л
23. Электролиттiң диссоциациялану дәрежесi=1, ал изотоникалық коэфицентi 2 болса, ол диссоцияланғанда түзiледi:
1. 3 ион
Ион
3. 4 ион
4. 5 ион
5. иондар түзiлмейдi
24. Натрий нитратының NaNO3 диссоциациялану дәрежесі 0,9 болса, оның изотоникалық коэффициенті:
1. 1
2. 2
3. 2,1
4. 1,8
5. 1,9
25.Бақа қанындағы заттардың осмостық концентрациясы 0,22 моль/л. Егер R = 0,082 (л.атм)/(град.моль) болса, онда 7 градуса С бақа қанының осмостық қымысы тең:
Атм.
2. 2,85 атм.
3. 0,13 атм.
4. 7,77 атм.
5. дұрыс жауап жоқ
6. Қышқылдық-негіздік тепе-теңдік.
1. Бір заттың қабаттар қалындығы бірдей екі ерітіндісінің түстеріде бірдей болса, олардың концентрациялары тең болады. Бұл заң бойынша ерітінділердің концентрациясын анықтайды:
1. кондуктометрия әдісін қолданып
2. потенциометрия әдісін қолданып
3. колориметрия әдісін қолданып
4. редоксометрия әдісін қолданып
5. хроматография әдісін қолданып
2. Ерітіндідегі сутек иондары концентрациясының теріс ондық логарифмі:
1. судың иондық көбейтіндісі
2. судың диссоциациялану константасы
3. сутектік көрсеткіш
4. гидроксидтік көрсеткіш
5. буферлік сиымдылық
3. Калориметриялық әдіспен рН мәні жуық мөлшерде анықталады:
1. универсал индикаторды қолданып
2. ерітіндінің электрөткізгіштігі бойынша
3. ерітіндінің электркедергісі бойынша
4. ерітіндінің қайнау температурасы көтерілуі бойынша
5. калий перманганты бойынша
4. Формула К ДИСС. =a2 * С- математикалық өрнегі:
1. Вант-Гофф занының
2. Оствальдтың сүйытылу заңы
3. Раульдің 2 ші занының
4. Раульдің 3- ші занының
5. Раульдің 1-ші занының
5. Қатынас С Н+ * СОН- = 10-14:
1. судың диссоциациялану константасы
2. судың иондық көбейтіндісі
3. тұрақсыздық константасы
4. Оствальдтың сүйылту заңы
5. сутектік көрсеткіш
6. Әлсіз электролиттердің диссоциациялану дәрежесі:
1. 30%-тен жоғары
2. 30% -тен кем
3. 3% -тен кем
4. 30-тен 90%-ке дейін
5. 100%-тен жоғары
7. Калориметриялық зерттеулерде буферлік ерітінділерден дайындаған эталондардың рН айырмалары болу керек:
1. 1
2. 0,2
3. 0,5
4. 0
5. 7
8. Күштi электролиттерден құралған қатар:
1. Н2 О, НCl, NaCl
2. KCl, CH3 COOH, NH4 OH
3. CH3 COOH, NH4 OH, H2 CO3
4. H2 CO3, HNO3, H2 SO4
5. KCl, NaOH, HNO3
9. Әлсiз электролиттiң диссоциациялану дәрежесi тәуелдi емес:
1. заттың концентрациясына
2. ерiткiштiң табиғатына
3. ерiген заттың табиғатына
4. температураға
5. араластыру жылдамдығына
10. Ерітінділердің концентрациясын түстерінің қоюлығы бойынша анықтау әдісінің атауы:
Калориметрия
2. кондуктометрия
3. комплексонометрия
4. редоксонометрия
5. ацидометрия
11. Электролиттiк диссоциациялану дәреже кемидi:
1. температураны көтергенде
2. ерiтiндiнiң концентрациясын арттырғанда
3. ерiтiндiге су қосып сұйылтқанда
4. иондық затты ерiткенде полюссiз ерiткiштi полюстi ерiткiшке ауыстырғанда
5. дұрыс жауабы жоқ
12. Өздерінің түсін ортаның рН-на тәуелді өзгертетің заттар:
1. катализаторлар
2. буферлік ерітінділер
Индикаторлар
4. комплексті қосылыстар
5. үлкен молекулалы қосылыстар
13. Ерітінділердің актив қышқылдығы анықталады:
1. қышқылдың жалпы концентрациясымен
2. ерітіндідегі сутек иондарының концентрациясымен
3. диссоциацияланбаған қышқылдың молекулаларының концентрациясымен
4. гидрокисд иондарының концентрациясымен
5. барлық қышқыл өнімдердің жалпы концентрациясымен
14. Концентрациясы 0,0001 моль/л HCl ерiтiндiсiнiң рН тең:
1. 10-4
2. 10-10
3. 4,0
4. 10
5. 8,0
15. Сутек иондарының концентрациясы сипаттайды:
1. ерітіндінің жалпы қышқылдығын
2. заттың ерітіндідегі диссоциациялану дәрежесін
3. ерітіндінің белсенді қышқылдығын
4. ерітіндінің буферлік сиымдылығын
5. ерітіндінің осмос қысымын
16. Ерiтiндiнiң жалпы қышқылдығы (титрленетiн қышқылдық) анықталады:
1. ерiтiндiдегi сутек иондарының концентрациясымен
2. ерiтiндiдегi гидроксил иондарының концентрациясымен
3. 100 мл ерiтiндiнi титрлеу үшiн жұмсалған концентрациясы 0.1 моль/л
сiлтi ерiтiндiсiнiң мл санымен
4. әрекеттесушi заттардың концентрациясы көбейтiндiсiмен
5. өнiмдердiң концентрациялары көбейтiндiсiмен
17. Қатынас СН+ > CОН- - сипаттайды:
1. ерiтiндiнiң қышқылдық ортасын
2. ерiтiндiнiң сiлтiлiк ортасын
3. ерiтiндiнiң нейтрал ортасын
4. буферлiк сиымдылықты
5. диссоциациялану дәрежесiн
18. Қатынас рН= рОН= 7 сәйкес келеді:
1. ерітіндінің сілтілік ортасына
2. ерітіндінің қышқылдық ортасына
3. ерітіндінің нейтрал ортасына
4. судың диссоциациялану константасына
5. еріген заттың диссоциациялану дәрежесіне.
19. Ерітіндінің сілтілік ортасын сипаттайтын сутек иондары концентрацияларының қатары:
1. 10-7, 10-12
2. 10-8, 10-12
3. 10-3, 10-7
4. 10-4, 10-10
5. 10-6, 10-3
20. Ерітіндінің қышқылдық ортасын сипаттайтын рН мәндерінің қатары:
1. 7 мен 10
2. 3 пен 7
3. 8 бен 4
4. 9 бен 10
Пен 2
21. Әлсiз электролиттерден құралған қатар:
1. глюкоза, Н2 О, NaOH
2. H2 CO3, NaCl, HCl
3. H2 O, CH3 COOH, H2 SO4
4. HCl, NaOH, KCl
5. CH3 COOH, H2 O, NH4 OH
22. Колориметрия әдісінің негізінде Ламберт-Беер заңы жатады. Бір заттың қабаттары
бірдей екі ерітіндісінің түстері де бірдей болса, олардың
1. концентрациялары тең
2. концентрациялары кері пропорционал
3. көлемдері бірдей
4. қасиеттері буферлік
5. қасиеттері коллоидтық
23. Еріткіш пен еріген заттан және олардың әрекеттесу өнімдерінен тұратын гомогенді жүйе атауы:
Ерітінді
2. электролизёр
3. реакциялық орта
4. комплексті қосылыс
5. еріткіш
24. Бренстед-Лоуридiң теориясы бойынша негіздер дегенiмiз -
1. протондарды қосып алатын бөлшек
2. протондармен әрекеттеспейтiн бөлшек
3. протонды үзiп жiберетiн бөлшек
4. протондары жоқ бөлшектер
5. электрондық жұптын доноры
25. Бренстед-Лоуридiң теориясы бойынша қышқылдар дегенiмiз.
1. протондарды қосып алатын бөлшек
2. протондармен әрекеттеспейтiн бөлшек
3. протонды үзiп жiберетiн бөлшек
4. протондары жоқ бөлшектер
5. электрондық жұптын доноры
7. Буферлік ерітінділер
1. Карбонат буфер жүйесі құралады:
1. көмір қышқылы мен натрий гидрокарбонаты ерітінділерінен
2. көмір қышқылы мен натрий карбонаты ерітінділерінен
3. көмір және сірке қышқылдары ерітінділерінен
4. натрий гидрокарбонаты және карбонаты ерітінділерінен
5. калий гидрофосфаты және дигидрофосфаты ерітінділерінен
2. 1л буферлік ерітіндінің рН мәнін бір бірлікке өзгерту үшін қосылатын күшті қышқыл немесе күшті негіздің эквивалент санының атауы:
1. буферлік жүйенің рН-ы
2. ерітіндінің буферлік сиымдылығы
3. ерітіндінің буферлік әрекетінің механизмі
4. қанның сілтілік резерві
5. жүйенің изоэлектрлік күйі
3. Әлсіз негізден және оның күшті қышқылдан түзілген тұзынан тұратын буферлік ерітінді:
Ацетат буфері
2. гемоглобин буфері
3. аммоний буфері
4. оксигемоглобин буфері
5. карбонат буфері
4. Буферлік ерітіндіге аз мөлшерде күшті қышқыл қосқанда оның рН мәні:
1. өзгермейді
2. кемиді
3. өседі
4. өсіп 7-ге жетеді
5. нольге дейін кемиді
5. Ақуыздық буферлік ерітіндіге дистилденген суды қосқанда оның буферлік сиымдылығы:
Кемиді
2. өзгермейді
3. өседі
4. нольге тең болады
5. рН 7-ге тең болады
6. Қалпында қанның рН= 7,36-7,40. Ацидоз кезінде қанның рН-ы:
1. қышқылдық жаққа өзгереді (рН<7,36)
2. сілтілік жаққа өзгереді (рН>7,40)
3. 7,36-7,40 аралығында болады.
4. рН= 09дейін кемиді
5. рН= 14 дейін артады
7. Көмiр қышқылының рК мәнi 6,35. Компоненттер ерiтiндiлерiнiң бiрдей
көлемдерiн араластырғанда гидрокарбонат буферiнiң рН мәнi 6,35 болады егерде:
1. тұздың концентрациясы қышқылдыкiнен артық болса
2. тұздың концентрациясы қышқылдыкiнен 10 есе кем болса
3. тұздың концентрациясы 3 есе артық болса
4. тұз бен қышқылдың концентрациялары тең болса
5. тұздың концентрациясы қышқылдыкiнен 3 есе кем болса
8. Алкалоз күйде қанның сілтілік резервісі қалпыңдағысынан:
1. өзгермейді
Артады
3. кемиді
4. рН= 7 дейін кеміп, одан кейін өседі
5. рН= 1
9. Тек белок буферлік жүйелер қатары:
1. аммоний, гемоглобин буферлері
2. аминқышқылдық және ацетат буферлері
3. аммоний, ацетат және фосфат буферлері
4. гемоглобин, оксигемоглобин және белоктар буферлері
5. белок, фосфат, ацетат буферлері
10. Буферлік ерітіндіге аз мөлшерде сілті ерітіндісін қосқанда оның рН мәні:
1. кемиді
2. өзгермейді
3. өседі
4. нольге тең болады
5. 7-ге тең болады
12. Ацидоз кезінде қанның сілтілік резервісі қалпындағысына:
1. артық
Кем
3. қалпында
4. рН=1
5. нольге тең
13. Биарбонат буферлік жүйе түзіледі араластынғанда:
1. көмір қышқылы мен натрий гидрокарбонатының ерітінділерін
2. көмір қышқылы мен натрий карбонаты ерітінділерін
3. натрий гидрокарбонаты мен карбонат ерітінділерін
4. натрий /калий/ гидрокарбонаты мен гидрофосфаты ерітінділерін
5. натрий /калий/ карбонаты мен фосфаты ерітінділерін
14. Адам қанының сілтілік резервісі қалыпты күйде тен:
1. СО2-ның 10-15 көлемдік процентіне
2. СО2-ның 90-100 көлемдік процентіне
3. СО2-ның 20-35 көлемдік процентіне
4. NaCl-дың 0,9 процентіне
5. СО2-ның 50-65 көлемдік процентіне
15. Буферлік ерітіндінің рН мәні тәуелді:
1. температураға, буферлік ерітінділер құрамындағы компоненттердің табиғатына, олардың концентрацияларының қатынасына
2. тек компоненттердің концентрациясына
3. қышқылдың концентрациясына
4. тұздың концентрациясына
5. негіздің концентрациясына
16. Қанның 75% буферлік сиымдылығынқамтамасыз ететін:
1. ацетат буфері
2. ацетат және аммоний буферлері
3. аммоний буфері
4. гемоглобин және оксигемоглобин буферлері
5. гемоглобин және ацетат буферлері
17. Формула рН= рК + lg 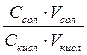 бойынша есептеледі
бойынша есептеледі
1. ерітіндінің буферлік сиымдылығы
2. буферлік ерітінділердің рН
3. қанның рН
4. изоэлектрлік күйдің рН
5. судың рН
18. Аз мөлшерде қышқыл немесе сілті немесе су қосып сұйылтқанда сутек иондарының концентрациясын /рН-ын/ тұрақты етіп сақтайтын ерітінділердің қасиетін:
1. буферлік сиымдылық дейді
2. буферлік әрекет немесе буферлік дейді
3. катализ дейді
4. плазмолиз дейді
5. гемолиз дейді
19. Аммоний буферіне аздап тұз қышқылын қосқанда эквивалент мөлшерде түзіледі:
1. күшті қышқыл
2. әлсіз қышқыл
3. күшті негіз
аммоний хлориді мен су
5. әлсіз негіз
20. Фосфат буферлік жүйе құралады:
1. фосфор қышқылы мен калий гидрофосфатының ерітінділерінен
2. фосфор қышқылы мен калий дигидрофосфатының ерітінділерінен
3. калий гидрофосфаты мен калий дигидрофосфатының ерітінділерінен
4. фосфор және көмір қышқылдарының ерітінділерінен
5. фосфор қышқылы мен калий ортофосфатының ерітінділерінен
21. Қанның буферлік жүйелеріне жатпайды:
1. фосфат буфері
2. гидрокарбонат буфері
3. ацетат буфері
4. гемоглобин буфері
5. оксигемоглобин буфері
22. Аммоний буферлік жүйесі құралады:
1. аммоний гироксиді мен натрий ацетатынан
2. аммоний гидроксиді мен хлоридінен
3. аммоний гидроксиді мен сірке қышқылынан
4. аммоний хлориді мен сірке қышқылынан
5. аммоний ацетаты мен аммоний хлоридінен
23. Буферлік ерітіндіге дистилденген суды қосқанда оның буферлік сиымдылығы:
1. кемиді
2. өзгермейді
3. өседі
4. нольге тең болады
5. рН 7-ге тең болады
24. Концентрациялары бірдей әлсіз қышқыл мен оның калий тұзының ерітінділері 5 мл-ден араластырылады. Қышқылдың рК = 4,80. Түзілген буферлік рН тең:
1. 6,80
2. 0,70
3. 9,20
4. 5,80
5. 4,80
25. Қатынас СН+ > CОН- сипаттайды:
1. ерiтiндiнiң қышқылдық ортасын
2. ерiтiндiнiң сiлтiлiк ортасын
3. ерiтiндiнiң нейтрал ортасын
4. буферлiк сиымдылықты
5. диссоциациялану дәрежесiн
8. Электродтық потенциал. Тотығу-тотықсыздану процестері. Потенциометрияның медицинада қолданылуы.
1.Кез келген электродтың нормальдi (стандартты) потенциалы ерiтiндiде металл ионының активтiлiгi 1моль/л-ге тең электродтан және … тұратын элементтiң Э.Қ.К. –не тең.
1.қаныққан каломелдi электродтан
2. ерiтiндiдегi а (Н+) =1 тең нормальдi сутектi электродтан
3.қаныққан хлоркүмiстi электродтан
4.ерiтiндiдегi а (Меn+) =1 тең кез келген металлдық электродтан
5.хингидронды электродтан
2.Өз тұзының ерітіндісіне батырылған металдық пластинаның заряды қандай болатынын көрсетіңіз:
1. тек теріс
2. тек оң
3. тек нөлге тең
4. оң, теріс және нөлге тең
5. өз тұзының ерітіндісіне батырылған металдық пластинаның заряды байқалмайды
3. Ерiтiндiдегi сутегi ионының концентрациясына потенциалы тәуелсiз электрод:
1.хингидронды
2.сутектi
3.шыны
4.каломелдi
5.дұрыс жауабы жоқ
4. Ортаның рН-ына келесi электродтың потенциалы тәуелдi:
1. каломелдi
2. мырышты
3. хлоркүмiстi
4. мысты
5. шыны
5. Потенциометриялық титрлеу әдiсiнде қышқыл мен сiлтiнiң концентрацияларын анықтау үшiн келесi параметрдi өлшеудi жүргiзедi.
1.ерiтiндiнiң электрөткiзгiштiгiн
2.ерiтiндiнiң кедергiсiн
3. ерiтiндiнiң эквиваленттi электрөткiзгiштiгiн
4.анықтаушы және салыстырмалы электродтардан құралған гальваникалық элементтiң электр қозғаушы күшiн
5. ерiтiндiнiң меншiктi электрөткiзгiштiгiн
6.Таза суға металды батырған кезде металда байқалатын заряд:
1.теріс
2.оң
3.нолге тең
4.металдың активтілігіне тәуелді: оң, теріс немесе нөлге тең
5.металды суға батырған кезде металда заряд байқалмайды
7.Құрамы немесе концентрациясы әртүрлi ерiтiндiлердiң аралығында шекарадағы потенциалдың секiрiсi:
1. стандартты потенциал
2. сутектi потенциал
3. диффузиялық потенциал
4. мембраналық потенциал
5. гальваникалық элементтiң электр қозғаушы күшi
8.Потенциометриялық титрлеу әдiсi нейтралдау, тұндыру, тотығу-тотықсыздану және комплекс түзу реакциялары бойынша келесi жағдайға негiзделген:
1. эквиваленттiк нүктеге жақын потенциалды ақырындап өлшеуге
2. эквиваленттiк нүктеге жақын потенциалды бiрден өлшеуге
3. отенциал түзушi ионның активтiлiгiне потенциалдың тура тәуелдiлiгiне
4. потенциал түзушi ионның активтiлiгiне потенциалдың толық тәуелсiздiгiне
5. дұрыс жауабы жоқ
9.Теңдеудегi электродты потенциалдың мәнiн есептеу үшiн ативтiлiктiң орнына концентрацияның мәнiн қандай жағдайда қолдануға болатынын көрсетiңiз
1.кез келген жағдайда
2.күштi концентрлi ерiтiндiлерде
3.сұйылтылған ерiтiндiлерде
4.активтiлiктiң орнына концентрацияны ешқашан қолдануға болмайды
5.стандартты жағдайда
10. Егер тұздың концентрациясы артса, онда өз тұзына батырылған металдық электродтың потенциалы қалай өзгеретінін көрсетіңіз:
1.өзгермейді
2.азаяды
3.артады
4.басында азаяды, одан кейін артады
5.мәні нөлге тең деп алынады және ары қарай өзгермейді
11.Электролит ерітіндісіне, мысалы өз тұзының ерітіндісіне батырылған металл өзін ток өткізетін жүйе ретінде көрсетеді және электрохимияда келесі түрде аталады:
1.индикатор
2.электрод
3.электролиттік ұяшық
4.адсорбент
5.катарометр
12. Өз тұзының ерітіндісіне батырған кезде ерітіндіге катиондарын беруге және теріс зарядталуға қабілетті:
1.активтілікке тәуелсіз барлық металдар
2.тек кернеулік қатарында сутегінен кейін тұрған металдар
3.тек химиялық активті металдар
4.сутегі және пассивті металдар
5.металдар тек оң зарядталуға қабілетті
13. Бұл  теңдеу
теңдеу
1. гальваникалық элементтің электр қозғаушы күшін анықтау үшін керек теңдеу
2. Вант-Гофф заңының математикалық өрнегі
3. электродтің тотығу-тотықсыздану потенциалын анықтау үшін керек Нернсттің теңдеуі
4. тотықтырғыш және тотықсыздандырғыштың эквивалентті массасын есептеу үшін формула
5. тотығу-тотықсыздану теңдеуіндегі элементтің тотығу дәрежесін есептеу үшін керек теңдеу
14. Теңдеудегi электродты потенциалдың мәнiн есептеу үшiн ативтiлiктiң орнына концентрацияның мәнiн қандай жағдайда қолдануға болатынын көрсетiңiз
1.кез келген жағдайда
2.күштi концентрлi ерiтiндiлерде
3.сұйылтылған ерiтiндiлерде
4.активтiлiктiң орнына концентрацияны ешқашан қолдануға болмайды
5.стандартты жағдайда
15. Заттар ерітінділерінің электр тоғын өткізу қабілетінің атауы:
1. электродтық потенциал
2. электродтардың поляризациялануы
3. диффузиялық потенциал
4. кедергілік
5. электрөткізгіштік
 2015-10-22
2015-10-22 3463
3463






