Лечение ПЭ, особенно ее тяжелых форм, сопряжено со значительными трудностями. Несмотря на использование новых методов лечения, летальность по-прежнему составляет 25-80% в зависимости от степени тяжести ПЭ. Необходимо подчеркнуть, что лечение ПЭ 3-4 стадии, к сожалению, характеризуется малой эффективностью, несмотря на высокую стоимость, вследствие чего чрезвычайно актуально своевременное выявление, профилактика и лечение латентной ПЭ.
В настоящее время комплекс лечебных мероприятий, проводимых при ПЭ, предусматривает:
- идентификацию и устранение разрешающих факторов;
- диетические мероприятия;
- медикаментозную терапию.
Кроме того, проводят общие мероприятия, к которым относятся назначение постельного режима больным с тяжелой ПЭ в первые дни лечения, что способствует уменьшению катаболических процессов, сопряженных с образованием аммиака в мышцах. При улучшении клинического состояния продление постельного режима нецелесообразно из-за усиления катаболизма белка в мышцах при развитии их атрофии.
Устранение разрешающих факторов
Кровотечения из желудочно-кишечного тракта. Для предупреждения энцефалопатии и печеночной комы у больных при кровотечении из варикозно расширенных вен пищевода и желудка рекомендуется удаление крови из кишечника при помощи высоких очистительных клизм, что также уменьшает всасывание в кишечнике аммиака, других продуктов распада и поступление их в кровоток. В целях дезинтоксикации больным внутривенно капельно вводят Гемодез, 5% раствор глюкозы. Для профилактики развития внутрикишечных инфекций показан прием антибиотиков (ампициллин, канамицин, неомицин, полимиксин М, метронидазол) и лактулозы (в клизмах - Дюфалак 300 мл на 1 л воды), которые, подавляя рост патогенной флоры, уменьшают образование азотистых соединений в кишечнике.
Хирургическое лечение применяется при отсутствии эффекта от вышеперечисленных методов лечения и продолжающемся кровотечении, представляющем угрозу для жизни больного. В этом случае производится гастростомия с прошиванием вен пищевода и желудка, чрезкожная эндоваскулярная эмболизация желудочных вен, эндоскопическое склерозирование пищеводных вен, электрокоагуляция, использование клея, а также трансъюгулярное внутрипеченочное портосистемное шунтирование и др. В настоящее время широко применяются эндоваскулярные методы - эмболизация печеночной и селезеночной артерии, баллонная окклюзия нижней полой вены в инфраренальном отделе, а также операции на грудном лимфатическом протоке и др. Необходимыми условиями для проведения оперативного вмешательства являются: отсутствие нарушения функции печени; выраженной активности патологического процесса (синдромы цитолиза, холестаза), молодой и средний возраст больного, отсутствие сопутствующих заболеваний.
В целях профилактики кровотечений из варикозно расширенных вен пищевода и желудка применяется неселективный β-адреноблокатор пропранолол (анаприлин) в дозе 40-80 мг в сутки (в течение 1-2 лет и более).
Однако, значительное нарушение функции печени, низкое АД, брадикардия, нарушение внутрисердечной проводимости являются показанием для уменьшения дозы пропранолола. Применение пропранолола на 61 % снижает частоту рецидивов кровотечений из варикозно расширенных вен пищевода и желудка, на 35% уменьшает летальность больных циррозом печени (Lewis, Davis, 1989).
Частота рецидивов кровотечений значительно уменьшается при комбинированной терапии β-блокаторами и нитратами. Для этого в качестве β-блокатора чаще используется надолол (поскольку препарат не метаболизируется в печени, обладает пролонгированным действием — его можно применять 1 раз в сутки).
В качестве нитрата длительного действия применяется изосорбида мононитрат. Начальная доза надолола 80 мг 1 раз в сутки внутрь. Дозу постепенно увеличивают до снижения частоты сердечных сокращений на 25% или до 50-55 в 1 минуту. После подбора дозы надолола, к лечению добавляют изосорбида-5-мононитрат, который также не метаболизируется в печени. Доза изосорбида увеличивается постепенно до 40 мг 2 раза в сутки, комбинированная терапия надололом и изосорбитом мононитратом проводится в течение 18 месяцев и дольше.
В качестве препаратов, уменьшающих вероятность развития кровотечений из варикозно расширенных вен пищевода, возможно применение антагонистов кальция, так как они снижают давление в портальной системе.
С целью профилактики повторных кровотечений при наличии варикозно расширенных вен пищевода и желудка целесообразно плановое оперативное лечение (сочетанная эмболизация печеночной и селезеночной артерий, баллонирование нижней полой вены, портокавальное шунтирование, операции на грудном лимфатическом протоке и др.).
Предотвращение обострения инфекции, санация очагов хронической инфекции. Развитие ПЭ при инфекциях, среди которых наблюдаются: инфекции дыхательных путей, мочевые инфекции, бактеремии, бактериальный эндокардит, спонтанный бактериальный перитонит, значительно реже – менингит, внелегочные формы туберкулеза, гнойный холангит. На долю инфекционных осложнений приходится 38-47%. Инфекционные осложнения служат непосредственной причиной смерти у 1/4 больных циррозом печени (Буеверов А. О., 1998).
Дезинтоксикационная терапия проводится по общепринятым принципам:
В целях дезинтоксикации больному вводятся внутривенно капельно 5% раствор глюкозы, раствор Рингера, изотонический раствор натрия хлорида. Глюкоза обеспечивает парентеральное питание, улучшает функциональную способность печени. Вместе с глюкозой в капельнице вводят: витамин С (1000 мг/сут), тиамина бромид 50 мг, пиридоксина – 50-100 мг, никотинамида – 100 мг.
Применяется также внутривенное капельное введение 400 мл Гемодеза, молекулы которого образуют соединения с физиологически активными веществами, что обеспечивает дезинтоксикационный эффект; Гемодез оказывает диуретическое действие, улучшает состояние системы микроциркуляции. В целом за сутки больному вводят около 2500-3000 мл жидкости под контролем центрального венозного давления (ЦВД), суточного диуреза. Перегрузка жидкостью опасна из-за нарастания асцита и возможности отека легких.
В лечении ПЭ широко применяют гемосорбцию, плазмосорбцию, криоферез. Возможно использование энтеросорбции, при этом можно применять волокнистый сорбент АУВ в дозе 6 г в сутки, энтеросорбент СКН по 10 г 3 раза в день в течение 10-14 дней; энтеродез по 5 г в 100 мл кипяченой воды 1 -3 раза в день в течение 5-10 дней; белосорб по 1 чайной ложке 3 раза в день в полстакана кипяченой воды; энтеросгель 10 г в 200 мл кипяченой воды 1-3 раза в день в течение 5-10 дней.
При лечении больных с хроническими заболеваниями печени необходимо разумно подходить к проведению диуретической терапии. Противопоказана массивная диуретическая терапия, важен четкий контроль за количеством введенной и выделенной жидкости. Необходимо помнить, что массивная диуретическая терапии часто приводит к усугублению ПЭ.
Электролитный дисбаланс. Для коррекции метаболического алкалоза показана калиевая диета, внутривенное капельное введение 50-80 мл 4% раствора калия хлорида в 500-1000 мл 5% растворе глюкозы. Целесообразно принимать во внимание, что на фоне гипонатриемии снижается терапевтическая активность диуретиков.
Запоры. Наиболее целесообразно использовать лактулозу (внутрь Дюфалак 10-60 мл в день), так как помимо слабительного эффекта, она уменьшает абсорбцию аммиака из кишечника.
Диетотерапия
При развитии ПЭ ограничивается содержания белка в суточном рационе до 20-50г. Причем рекомендуется отказ от белков животного происхождения и преимущественное использование белков растительного происхождения, которые обладают меньшим аммониегенным эффектом, содержат мало метионина и ароматических аминокислот и наделены более выраженным слабительным эффектом. Количество жиров в суточном рационе составляет 80 г, углеводов — 200-300 г.
Энергетическая ценность пищи должна превышать 1500 ккал/день, что приводит к снижению интенсивности процессов катаболизма и соответственно к снижению выраженности гипераммониемии. Основной рацион больного состоит главным образом из овощных блюд: овощные супы, каши, картофельное пюре, кисели, суфле, фрукты, соки, морс, лимонад.
В период угрожающей печеночной комы прекращают пероральный прием пищи. Питание энергетической ценностью до 1600 ккал обеспечивается введением через желудочный зонд или внутривенно 5-20% раствора глюкозы (общее количество глюкозы, введенной в течение суток, составляет 200-300 г).
Через 7-8 дней после выхода из состояния прекомы разрешают употреблять 20 г белка в сутки, затем содержание белка в пище увеличивают каждые 3 дня на 10 г до ежедневного потребления в дозе 1 г на 1 кг массы тела под контролем состояния больного.
Долгосрочное ограничение содержания белка в рационе больных с ПЭ в настоящее время не применяют, так как оно способствует катаболизму эндогенных белков и, как следствие, повышению в крови азотосодержащих соединений. Исключение составляют больные с белковой интолерантностью, которую диагностируют на основании ухудшения клинических показателей и результатов выполнения психометрических тестов после приема белковой пищи.
Медикаментозная терапия
При ПЭ используют общий комплекс мероприятий. Направленных на поддержание основных жизненно важных функций. В зависимости от точки приложения все применяемые лекарственные средства можно разделить на несколько групп.
Первая группа включает в себя препараты, направленные на снижение степени гипераммониемии. По механизму действия их можно разделить на:
1) уменьшающие образование аммиака в кишечнике (лактулоза (Дюфалак), антибиотики);
2) усиливающие обезвреживание аммиака в печени (L-орнитин- L -аспартат, орнитин - α- кетоглутарат); 3) связывающие аммиак в крови (натрия бензонат, натрия фенилацетат).
К препаратам, уменьшающим образование аммиака в кишечнике, относится Лактулоза (Дюфалак). Это невсасывающийся синтетический дисахарид, который расщепляется в толстой кишке под действием уреазонегативных лактобактерий на молочную и уксусную кислоты, что приводит к закислению кишечного содержимого, что способствует росту бактерий, расщепляющих лактозу, при этом подавляется рост аммониегенных микроорганизмов, особенно Esherihia coli.
Кислая среда кишечника может уменьшать ионизацию и всасывание аммиака, аминов и других токсичных азотсодержащих соединений. В то же время этот препарат повышает осмотическое давление в толстом кишечнике, что является мерой профилактики запоров - одного из факторов развития ПЭ. К числу побочных эффектов относятся возможное развитие метеоризма и поносов. Дозу подбирают индивидуально - от 30 до 120 мл/сут. Оптимальной считают дозу, при которой достигается мягкий стул 2-3 раза в сутки.
При тяжелой ПЭ препарат применяют одновременно внутрь и в виде клизм. Клизмы с лактулозой назначают 2 раза в день (300 мл препарата разводят 700 мл воды). При лечении острых стадий ПЭ дозы препарата значительно увеличиваются и составляют от 300 до 700 мл лактулозы на 1 литр воды с повторным введением через каждые 6-8 часов. Ректальное введение лактулозы в виде очистительных клизм приводит к быстрому снижению концентрации аммиака, что сопровождается достаточно выраженным клиническим улучшением.
Следует иметь ввиду, что при нарушении глотания целесообразно вводить лактулозу через желудочный зонд в дозе 15-30 мл 4 раза в день. Учитывая, что Дюфалак имеет консистенцию вязкого сиропа, необходимо перед зондовым введением разводить его водой. Положительный эффект лечения ПЭ лактулозой отмечается у 60-70% больных.
Антибактериальная терапия используется с целью уменьшения образования токсинов, в том числе аммиака в толстой кишке. Антибиотики применяются внутрь в виде водной суспензии, а также в клизмах или через назогастральный зонд. Применение ранее употреблявшихся с этой целью неомицина (4-6 г/сут), мономицина нежелательно из-за их нефро- и ототоксического эффекта. В настоящее время наиболее широко применяются рифаксимин (1200 мг/сут в 3-4 приема), ципрофлокса-цин (250 мг 2 раза в день), метронидазол (1-2г/сут в 3-4 приема). При совместном использовании лактулозы и невсасывающихся антибиотиков проявляется их синергический эффект, за счет воздействия на разные группы микроорганизмов кишечника.
Эффективность антибиотиков сходна с таковой лактулозы. Существенным недостатком лечения антибиотиками является ограниченная продолжительность их применения (5-7 дней), широкий спектр побочных эффектов и потенциально токсических воздействий, в связи с чем их невозможно использовать с целью длительной профилактики ПЭ.
Для подавления микрофлоры кишечника кроме антибактериальных препаратов применяют высокие очистительные клизмы, что может быть назначено на более длительные сроки для профилактики ПЭ.
К препаратам, стимулирующим обезвреживание аммиака в печени и мышцах относятся L-орнитин-L-аспартат, орнитин-α-кетоглутарат (орнитин-α-КГ).
L-орнитин-L-acnapmam активизирует основные процессы утилизации аммиака путем стимуляции синтеза мочевины в гепатоцитах. Препарат активизирует основные процессы утилизации аммиака путем стимуляции синтеза мочевины в гепатоцитах. L-орнитин-L-аспартат, стимулирует обезвреживание NH3 в печени путем нормализации цикла синтеза мочевины.
Основные составляющие препарата, встраиваясь на ключевых этапах в реакции орнитинового цикла, способствуют восстановлению нормального хода данного циклического процесса на этапах синтеза цитруллина, аргинин-сукцината и глутамина. L-орнитин стимулирует карбамоил-фосфатсинтетазу и орнитин-карбамоил-трансферазу, является акцептором карбамоильной группы при образовании цитруллина.
Другая составляющая препарата, L-аспартат, участвует в синтезе аргинин-сукцината и активирует глутамат-синтетазу при образовании глутамина. Кроме того, L-орнитин-L-аспартат ингибирует катаболизм белка в мышцах, нормализует соотношение аминокислот крови и оказывает выраженный антиоксидантный эффект.
Препарат применяется на первом этапе внутривенно капельно 20-40 г в сутки на 400 мл 0,9% раствора натрия хлорида, при этом скорость инфузии не должна превышать 5г/ч. В этот период L-орнитин-1-аспартат можно применять в сочетании с лактулозой. На втором этапе лечения, при уменьшении степени тяжести ПЭ, переходят на прием пероральной формы L-орнитин-L-аспартата в дозе 18 г в сутки в три приема за 30 мин до еды.
Использование этого механизма является перспективным направлением в лечении ПЭ, так как позволяет стимулировать функцию основных органов обезвреживания аммиака при хронических заболеваниях печени. Механизм действия и эффективность орнитин-α-КГ аналогичны.
К препаратам, связывающим аммиак в крови относятся бензоат натрия и натрия фенилацетат. Эти препараты связывают аммиак крови с образованием соответственно гиппуровой кислоты и фенилацетилглутамина. Эффект действия наступает быстро, однако он непродолжителен. Бензоат натрия широко применяют в педиатрической практике для лечения больных с врожденными синдромами гипераммониемии. В лечении ПЭ препараты применяют редко.
Вторая группа лекарственных препаратов для лечения ПЭ, действие которых направлено на уменьшение тормозных процессов в ЦНС. К этой группе относится антагонист бензодиазепиновых рецепторов флумазенил. Механизм его действия связан со снижением тормозных процессов в головном мозге.
Выраженность симптомов ПЭ уменьшается через 1-1,5 ч от начала внутривенного введения флумазенила в дозе 0,4-1 мг и сохраняется на этом уровне около 2 часов после его отмены. Флумазенил высокоэффективен при лечении ПЭ, разрешающим фактором при развитии которой является прием седативных препаратов и бензодиазепинов. Отсутствие положительного эффекта после внутривенного введения препарата считается неблагоприятным прогностическим признаком.
К третьей группе средств, применяемых при лечении ПЭ, относятся препараты с различным механизмом действия, обладающие гепатотропным, антиоксидантным, антифибротическим и другими эффектами, нормализующими обменные процессы в печени.
Гипотеза нарушения аминокислотного баланса при циррозе печени нашла отражение в применении разветвленных аминокислот (Гепасол) у больных с ПЭ. В состав Гепасола входят L-аргинин и L-аспарагиновая кислота, яблочная кислота, сорбит, рибофлавин. Гепасол оказывает метаболическое, гепатопротекторное и дезинтоксикационное действие.
Эффект препарата основан на влиянии L-аргинина на процессы метаболизма. Он способствует превращению аммиака в мочевину, связывает токсичные ионы аммония, образующиеся при катаболизме белков в печени. Яблочная кислота и сорбит обеспечивают организм энергией.
В качестве дополнения к основной терапии используется цинксодержащие витаминные комплексные препараты. Механизм действия цинка основан на снижении им активности перекисного окисления липидов (ПОЛ) и участии в метаболизме как кофактора многих ферментов, в том числе ферментов синтеза мочевины.
Вопрос о применении кортикостероидов в лечении ПЭ остается спорным. Так, по результатам мультицентрового рандомизированного контролированного исследования, проводившегося с целью оценки эффективности приема гидрокортизона при лечении острой печеночной недостаточности с ПЭ, статистически значимых различий в показателях выживаемости между группами больных, получавших плацебо и гидрокортизон в дозах 400 и 800 мг, не было.
У пациентов с тяжелой, прогрессирующей и резистентной к терапии ПЭ, а также у больных с фульмининантной печеночной недостаточностью единственным эффективным способом лечения является трансплантация печени.
ВЕДЕНИЕ ПАЦИЕНТА С ЛАТЕНТНОЙ ПЕЧЕНОЧНОЙ ЭНЦЕФАЛОПАТИЕЙ
При лечении пациентов с латентной формой ПЭ может использоваться как комбинация лактулозы (Дюфалака) и L-орнитин-L-аспартат, так и применение одного из этих препаратов в качестве монотерапии. У пациентов, склонных к запорам, целесообразно применение лактулозы, обладающей свойствами слабительного. Однако развитие метеоризма и диареи часто ограничивает возможность увеличения дозы препарата. У части пациентов по мере приема препарата метеоризм может нивелироваться, тем не менее примерно 1/3 пациентов вынуждена сочетать прием лактулозы с симетиконом. У пациентов, склонных к послаблению стула, целесообразно выбрать в качестве монотерапии L-орнитин-L-аспартат (рис. 8).

Рисунок 8. Алгоритм подбора терапии у пациентов с латентной формой ПЭ.
Нами было проведено исследование по сравнению эффективности различных схем терапии больных с латентной ПЭ, включающих лактулозу (Дюфалак) и L-орнитин-L-аспартат.
Под наблюдением находилось 39 пациентов с хроническими заболеваниями печени различного генеза (хронический гепатит минимальной степени активности и цирроз печени А класса по Чайлд-Пью), у которых выявлялась ЛПЭ. Среди обследуемых были 22 мужчина в возрасте от 46 до 62 лет (в среднем 52,4±3,8 лет) и 17 женщин в возрасте от 41 до 69 лет (в среднем 56,5±4,2 лет). Манифестация клинических проявлений (по данным анамнеза заболевания) и срок наблюдения за этими пациентами в среднем составили от 1 до 36 месяцев.
Для верификации хронического заболевания печени и определения тяжести его течения, наряду с общеклиническими методами (общий анализ крови, расширенный биохимический анализ сыворотки крови), были проведены инструментальные методы исследования: ЭГДС, УЗИ органов брюшной полости, статическая гепатосцинтиграфия с 99Тс, КТ органов брюшной полости и забрюшинного пространства, а также пункционная биопсия печени под контролем УЗИ с целью определения степени активности воспаления и степени прогрессирования фиброза по индексу гистологической активности шкалы Knodell. Всем больным проводилось исследование на маркеры вирусных гепатитов.
В исследование включались только пациенты с латентной ПЭ. Учитывая трудности диагностики латентной ПЭ, нами были выбраны для скрининга психометрические тесты на цифровую последовательность (определялось время выполнения теста), тест линий (определялось время и количество допущенных ошибок) и тесты анализа психоэмоционального состояния пациента с оценкой уровня тревоги и депрессии. Исследование психоэмоционального статуса проводилось по результатам теста Гамильтона и Спилбергера-Ханина. Также проводились беседы с родственниками больных о динамике изменений характера, почерка и поведенческих реакций.
Из биохимических показателей сыворотки крови оценивались: АлАТ, АсАТ, γ-глутамилтранспептидаза, щелочная фосфатаза, билирубин, холестерин, общий белок, мочевина и аммиак. Все пациенты осматривались невропатологом и психиатром для исключения другого генеза энцефалопатии, кроме печеночного. Из инструментальных методов диагностики нарушений функции мозга использовались ЭЭГ с оценкой показателей амплитуды волны, количества фаз, частоты α-ритма и наличия вспышек θ-волн, а также магнитно-резонансная спектроскопия головного мозга, являющаяся «золотым стандартом» в определении латентной ПЭ.
Обследуемые пациенты были рандомизированы на три группы в зависимости от проводимой терапии. Группы были сопоставимы по возрасту и полу пациентов, по длительности анамнеза заболевания печени. Результаты исследования регистрировались и оценивались до лечения, а также во время лечения на 14-й и 28-ой дни.
Больным первой группы (15 человек) для лечения латентной ПЭ назначался Дюфалак курсом 28 дней. Учитывая рекомендации многочисленных рандомизированных контролируемых исследований подбор доз Дюфалака осуществлялся, индивидуально для каждого пациента с учетом изменения характера его стула (консистенции, объема и числа дефекаций) от 30 до 60 мл в сутки. Пациенты второй группы (13 человек) получали L-орнитин-L-аспартат перорально 9 г в сутки в три приема за 30 мин до еды в течение 28 дней. Больным третьей группы (11 человек) проводилась комплексная терапия, включающая Дюфалак и L-орнитин-L-аспартат по вышеописанным схемам.
Достоверность различий показателей в исследуемых группах оценивали по критерию достоверности Фишера и по 7-критерию Стьюдента.
Качество проводимой терапии латентной ПЭ оценивалось по результатам психометрических тестов и нормализации психоэмоционального статуса, также в динамике оценивались биохимические показатели сыворотки крови (АлАТ, АсАТ, билирубин, холестерин, щелочная фосфатаза, γ-глутамилтранспептидаза, общий белок, мочевина, аммиак) и данные ЭЭГ. Оцениваемые показатели сравнивались до начала лечения, на 14-ый и 28-ой дни лечения по группам.
Основным методом диагностики и оценки динамики латентной ПЭ в исследовании было использование психометрического тестирования с применением теста связи чисел и теста линий. Для дополнительного сравнения результатов тестов с нормальными показателями нами было проведено тестирование здоровых лиц (27 человек, в возрасте от 48 до 62 лет), которое зафиксировало среднюю величину времени выполнения теста на цифровую последовательность на уровне 39,4+3,2с. Тест линий, проводимый у здоровых лиц, выявил, что время его выполнения составило 28,2+2,1с, а число ошибок - 0,7+0,03. Анализ результатов психометрических методов исследования показал, что время выполнения теста на цифровую последовательность и теста линий, а также число ошибок при выполнении теста линий, значительно уменьшились у пациентов 3-ей группы в сравнении с пациентами 1-ой и 2-ой групп, получавшими монотерапию (рис. 9).

Рисунок 9. Изменение результатов выполнения психометрических тестов у больных до и после лечения (в секундах). Примечание: * - р < 0,05
Результаты проведенных тестов до лечения между группами больных достоверно не отличались (р>0,05) и составили в целом для трех групп 58,7+1,9с при выполнении теста на числовую последовательность, 41,3+1,3с и 3,7±0,2 ошибок для теста линий. После проведенного лечения достоверно лучшие результаты были получены у пациентов, получающих комплексную терапию, в этой группе показатели тестов стали близки к нормальным уже на 14-ый день лечения и составили: тест чисел - 45,4±2,1с, тест линий - 34,8±1,2с и 1,5±0,07 ошибок (р<0,05). К 28-ому дню лечения у пациентов 3-ей группы показатели выполнения психометрических тестов стали нормальными: тест чисел - 35,1±1,7с, тест линий - 23,7±1,2с и 0,6±0,02 ошибок (р<0,001). В 1-ой и во 2-ой группах хорошие результаты были получены только на 28-ой день лечения: тест чисел в 1-ой группе составил 39,5±2,5с и во 2-ой группе - 41,7±2,1с; тест линий 28,2±1,1с и 30,4±1,5с, 1,8±0,09 ошибок и 1,3±0,05 ошибок, соответственно (р<0,05).
До начала лечения результаты психологического тестирования с использованием шкал Гамильтона и Спилбергера-Ханина в целом показали, что легкая степень тревожности определялась у 43,6% (n=17) больных, умеренная степень – у 25,6% (n=10) и высокая - у 2,6% больных (n=1) и тревожность отсутствовала у 28,2% (n=11). Уже на 14-й день лечения отмечалась тенденция в нормализации показателей тревожности и в группах значительно увеличилась доля больных с легкой степенью тревоги в первой группе до 66,7% (от исходного значения 46,7%), во второй - до 61,5% (от исходного значения 38,5%), а в третьей группе этот показатель составил 18,2% (при исходном значении 45,5%) за счет увеличения доли больных без тревожности до 91,0%. На 28-ой день терапии доля тревожности достоверно уменьшилась во всех группах и особенно в третьей группе, где тревожность не выявлялась у всех 11 (100%) больных, в первой группе – у 60% больных и во второй группе – у 73,3% больных (рис. 10).
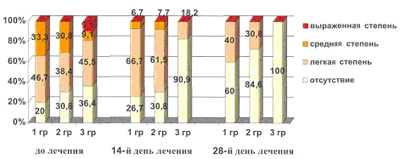
Рисунок 10. Изменение уровня тревожности у больных до и после лечения (в процентах).
Сравнительный анализ полученных результатов психометрического и психологического тестирования показал, что в группе больных, получавших комплексную терапию с включением Дюфалака и Х-орнитин-Х-аспартата, отмечалось их достоверное улучшение, коррелирующее с изменениями ЭЭГ. Критериями качества проводимой терапии ПЭ по данным' ЭЭГ было повышение амплитуды волны электроэнцефалограммы, увеличение частоты α-ритма и уменьшение вспышек θ-волн, указывающие на нормализацию функции мозга. До лечения у пациентов 1-ой группы, принимающих Дюфалак, низкоамплитудные волны ЭЭГ регистрировались в 60% случаев, а на 28-ой день лечения - в 46,7% случаев; во 2-ой группе этот показатель составил – 69,2% до лечения и 46,2% на 14-ый день лечения; в 3-ей группе – 63,6% и 27,3%, соответственно. Следовательно, при сравнении полученных данных до и после лечения, нормализация амплитуды волн была достоверной во всех группах (р<0,05). До лечения снижение частоты α-ритма выявляли в 1-ой группе у 86,7% больных и после лечения – у 40,0%, во 2-ой группе – у 84,6% и 46,2%, и в 3-ей - у 81,8% и 18,2%, соответственно (р<0,05). Наличие θ-волн отмечали в 1-ой группе у 33,3% больных и после лечения – у 13,3%, во 2-ой группе – у 38,5% и 7,7%, и в 3-ей – у 36,4% и не обнаружено ни у одного пациента после лечения (р<0,05).
После проводимой терапии биохимические показатели сыворотки крови также достоверно улучшались во всех трех группах (табл. 11).
Показатели общего белка, биллирубина, холестерина, протромбинового индекса, отражающие белково-синтетическую функцию печени, улучшились на фоне проводимого лечения, причем наиболее значительно у больных 3-ей группы (р<0,05). Дезинтоксикационная функция печени, оцениваемая по содержанию аммиака в сыворотке крови, на фоне терапии также нормализовывалась, причем, наиболее убедительно у пациентов 3-ей группы. У пациентов этой группы отмечалось и более выраженное снижение уровня аммиака в сыворотки крови, значимо коррелирующее с улучшением клинических и психометрических показателей (р<0,05).
 2017-12-14
2017-12-14 478
478






