Вопрос 18.
1. Коллигативные свойства растворов — это те свойства, которые при данных условиях оказываются равными и независимыми от химической природы растворённого вещества; свойства растворов, которые зависят лишь от количества кинетических единиц и от их теплового движения.
2. Коллигативные свойства – это свойства растворов, зависящие от концентрации частиц растворенного вещества и не зависящие от природы.. К коллигативным свойствам растворов относят:
1) понижение давления насыщенного пара растворителя над раствором,
2) понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей.
3) осмотическое давление.
1. Осмотическое давление- такое давление, которое нужно приложить к раствору отделённому от растворителя полупроницаемой перегородкой, чтобы наступило состояние равновесия
а) изотонический раствор раствор, имеющий одинаковое осмотическое давление
б) Гипертонический раствор – раствор имеющий высокое осматическое давление, концентрация растворенных веществ выше чем концентрация растворителя
в) Гипотонический раствор- раствор с меньшей концентрацией и меньшим осматическим давлением.
Давление насышеного пара – это P при котором при определённой T наступает динамическое равновесие, характеризущееся равенстовм v испарения и конденсации жидкости.
3. T кип. 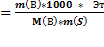 4. Тзам
4. Тзам 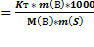 – понижение Tзам – криоскопия.
– понижение Tзам – криоскопия.
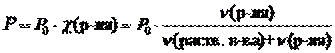
1 закон Рауля. Давление насыщенного пара растворителя над раствором пропорционально мольной доле растворителя.
 ,
,
где Р – давления насыщенного пара растворителя над раствором, Па;
Р0 – давления насыщенного пара над растворителем, Па;
c(р-ля) – мольная доля растворителя;
n(раств. в-ва) – количество растворенного вещества, моль;
n(р-ля) – количество вещества растворителя, моль.
Иногда закон Рауля определяют следующим образом. Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
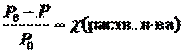 или
или 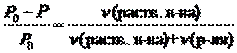 ,
,
где c(раств. в-ва) – мольная доля растворенного вещества.
2 закон Рауля. Понижение температуры замерзания и повышение температуры кипения растворов по сравнению с таковыми для чистого растворителя пропорциональны моляльной концентрации растворенного вещества:

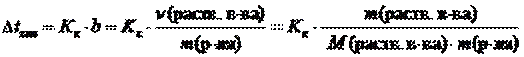 ,
,
где Dtкип – повышение температуры кипения раствора, °С;
Dtзам – понижение температуры замерзания раствора, °С;
Кэ – эбуллиоскопическая константы растворителя, (кг×°С)/моль;
Кк – криоскопическая константы растворителя, (кг×°С)/моль;
b – моляльная концентрация, моль/кг;
n(раств. в-ва) – количество растворенного вещества, моль;
m(р-ля) – масса растворителя, кг;
m(раств. в-ва) – масса растворенного вещества, г;
М(раств. в-ва) – молярная масса растворенного вещества, г/моль.
Зная температуры кипения и замерзания чистых растворителей и Dt можно рассчитать температуры кипения и замерзания растворов:
tкип.(р-ра) = tкип.(р-ля) + Dtкип. tзам.(р-ра) = tзам.(р-ля) – Dtзам.
Вопрос 19.
НЕЭЛЕКТРОЛИТОВ – это растворы не проводящие или плохо проводящие электрический ток.
Коллигативные свойства – это свойства растворов, зависящие от концентрации частиц растворенного вещества и не зависящие от природы.. К коллигативным свойствам растворов относят:
1) понижение давления насыщенного пара растворителя над раствором,
2) понижение температуры замерзания
3) повышение температуры кипения растворов
4) осмотическое давление.
Закон Рауля для неэлектролитов
У идеальных растворов (как и у идеальных газов) некоторые свойства не зависят от природы растворенного вещества. Такие свойства получили название коллигативных (общих) свойств растворов. Одним из важнейших коллигативных свойств идеальных растворов является давление насыщенного пара растворителя над раствором. Вследствие того, что при растворении нелетучего компонента в поверхностном слое жидкости концентрация молекул растворителя уменьшается, уменьшается и давление ее пара P по сравнению с давлением насыщенного пара над чистым растворителем P0:
Количественно это выражается Законом Рауля:
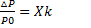 где ∆ P = P0 – P, а Xk – мольная доля растворенного вещества.
где ∆ P = P0 – P, а Xk – мольная доля растворенного вещества.
Закон Рауля гласит: отношение понижения давления пара растворителя над раствором нелетучего вещества к давлению пара чистого растворителя равно мольной доле растворенного вещества.
Следствиями Закона Рауля являются повышение температуры кипения раствора по сравнению с температурой кипения чистого растворителя (∆ Tкип.= Tкип 2 - Ткип 1) и понижение температуры кристаллизации растворителя из раствора по сравнению с температурой кристаллизации чистого растворителя (∆ Tкрист. = Тзам 2 – Тзам 1).
Количественно эти следствия описываются так:
∆ Tкип.= EкипCm
∆ Tкрист. = KзамCm
где Eкип – эбуллиоскопическая постоянная растворителя
Кзам – криоскопическая постоянная растворителя Сm – моляльная концентрация раствора.
Вопрос 20.
Растворы электролитов.
Электролиты – вещества, растворы или расплавы проводящий электрический ток.
Электролиты – это системы, содержащие способные к самостоятельному существованию ионы. (Кроме растворов способностью проводить электрический ток за счет ионной проводимости обладают и расплавы электролитов).
Понижение давления пара растворителя над раствором определяется в основном количеством растворенных частиц. Однако количество растворенных частиц в растворах электролитов, в отличие от растворов неэлектролитов, определяется не только концентрацией раствора, но и степенью диссоциации электролита, поскольку все молекулы или часть молекул электролита в растворе распадаются на ионы. Применяя закон Рауля к растворам электролитов Вант-Гофф ввел поправочный коэффициент i в уравнение для осмотического давления Р = С R Т.
Коэффициент i, учитывает увеличение числа частиц в растворе в результате электролитической диссоциации: dр/р0i = i Х2 (Р = i С R Т).
Коэффициент диссоциации i показывает, во сколько раз число частиц в растворе электролита больше числа частиц в растворе неэлектролита той же концентрации, (для растворов неэлектролитов i=1, а для растворов электролитов 
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойствараствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы:
Вопрос 21.
В растворе электролита имеет место электролитическая диссоциация с образованием ионов. Эта идея была выдвинута С.Аррениусом.
Диссоциация – самопроизвольный распад электролита на ионы.
Положительно заряженные ионы называются катионами, отрицательно заряженные – анионами.
Распад электролитов на ионы объясняет отклонения от законов Рауля и Вант-Гоффа. Так, хлорид натрия переходит в раствор в виде ионов Na+ и Cl‾. При этом из одного моля NaCl получается не 6,02 . 1023 частиц, а вдвое больше. Поэтому и понижение температуры замерзания в растворе NaCl должно быть вдвое больше, чем в растворе неэлектролита той же концентрации.
Точно так же в очень разбавленном растворе BaCl2, диссоциирующего по уравнению
BaCl2 = Ba2+ + 2Cl‾,
осмотическое давление оказывается в 3 раза больше чем, если бы хлорид бария находится в нем в виде молекул BaCl2.
Таким образом, особенности водных растворов электролитов, противоречащие с первого взгляда законам Рауля и Вант-Гоффа, были объяснены на основе этих же законов.
Однако теория Аррениуса не учитывала всей сложности явлений в растворах. Она рассматривала ионы как независимые от растворителя частицы. Но ей противостояла гидратная теория Менделеева, в основе которой лежало представление о взаимодействии растворенного вещества с растворителем. Кажущееся противоречие обеих теорий было устранено предположением о гидратации ионов (И.А. Каблуков). Развитие этой идеи привело к объединению теорий Аррениуса и Менделеева.
Распадаться на ионы могут только те молекулы, в которых химическая связь имеет достаточно высокую степень ионности. Чтобы ионы молекулы электролита меньше притягивались друг к другу, растворитель должен обладать высоким значением относительной диэлектрической проницаемости (ε). Распаду электролита способствуют растворители с высоким значением ε. К ним относится вода (ε = 80,1), уксусная кислота (ε = 57),этиловый спирт (ε = 25).
Вещества могут распадаться на ионы и при расплавлении, когда энергии теплового движения оказывается достаточно для разрыва полярных связей.
Таким образом,
электролитическая диссоциация – это процесс распада молекул веществ на ионы под действием полярных молекул растворителя, а также при их расплавлении.
В зависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация протекает по-разному. Наиболее типичны два случая. В одном - диссоциация протекает при растворении веществ с ионной структурой, в другом - при растворении веществ с полярной связью.
Когда кристалл соли с ионной связью попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (это ион дипольное взаимодействие). Ионы вещества и молекулы воды притягиваются друг к другу противоположными полюсами. Ионы испытывают тепловые колебания и толчки со стороны молекул воды и этого достаточно, чтобы ионы перешли из кристалла в раствор. Вслед за первым слоем ионов в раствор переходит следующий слой и таким образом происходит растворение кристаллических веществ с ионной связью.
Полярные молекулы растворяющихся веществ притягивают к себе полярные молекулы воды за счет диполь – дипольного взаимодействия, вызывая расхождение полюсов молекулы вещества. Происходит поляризация молекулы, которая совместно с колебательным движением атомов и тепловым движением молекул воды приводит к распаду полярной молекулы на ионы. Образующиеся в обоих случаях ионы гидратируются. При этом ион водорода Н+ (протон) прочно связывается с молекулой воды в ион гидроксония Н3О+. Схематически это можно представить уравнением:
Н2О + НCl = Н3О+ + Cl‾.
В результате этого процесса общая пара электронов молекулы НCl остается у атома хлора, который превращается в ион Cl‾, а протон, внедряясь в электронную оболочку кислорода молекулы воды, образует ионгидроксония Н3О+.
Протон водорода благодаря малым размерам и электростатическому полю высокой напряженности, а также отсутствию у него электронной оболочки, в водных растворах существует только в виде комплексов с молекулами воды Н3О+ окруженных другими молекулами воды.
Перешедшие в раствор ионы остаются связанными с молекулами воды и образуют гидраты ионов. В случае другого растворителя эти соединения называются сольватами ионов. Но в уравнениях диссоциации обычно пишут формулы ионов, а не их гидратов или сольватов.
Чем более похожи по характеру и энергетике химических связей растворитель и растворяемое вещество, тем растворимость, как правило, больше. Это утверждение обобщается правилом, известным ещё с «алхимических времен» - подобное растворяется в подобном.
С точки зрения классической физики процесс электролитической диссоциации обусловлен тем, что среда растворителя с высоким значением диэлектрической проницаемости ослабляет электростатическое
взаимодействие в ионных соединениях и увеличивает длину диполя
полярных молекул. Это может приводить к распаду исходного вещества на
ионы и порождать другие необычные эффекты. Таким образом роль растворителя неоценима в ТЭД, так как без его участия диссоциация не протекает вовсе.
Степень диссоциации: α – отношение числа молекул распавшихся на ионы к общему числу молекул. 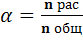
Степень диссоциации зависит от:
1. T (увеличивается с повышение температуры)
2. От концентрации раствора
3. От природы электролита.
Классификация электролитов:
1) Электролиты слабые. α ≥ 3%
2) Электролиты средней силы 3% ≤ α ≤ 30%
3) Электролиты сильные α ≥ 30%
К сильным электролитам относятся:
1) Почти все соли;
2) Некоторые минеральные кислоты, такие как H2SO4, HNO3, HCl, и
некоторые другие;
3) Основания щелочных и щелочноземельных металлов, например,
NaOH, KOH, Ba(OH)2.
К слабым электролитам относятся:
1) Почти все органические кислоты, например муравьиная HCOOH,
уксусная CH3COOH;
2) Некоторые минеральные кислоты, например, H2CO3, H2S, HNO2, HClO.
3)Многие гидроксиды металлов (кроме гидроксидов щелочных и
щелочноземельных металлов), например Fe(OH)3, Мn(OH)2, а также
гидроксид аммония NH4OH.
К слабым электролитам относится вода
Вопрос 22.
Диссоциация — обратимый процесс. Это означает, что наступает такое состояние равновесия, при котором сколько молекул распадается на ионы (диссоциация), столько их вновь образуется из ионов (ассоциация). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости.
Ступенчатая диссоциация. Многоосновные кислоты и многокислотные основания диссоциируют ступенчато, последовательно отщепляя ионы водорода или ионы гидроксильных групп. Каждая ступень диссоциации характеризуется своим значением константы диссоциации. Легче всего происходит отщепление первого иона, так как отрыв второго и последующих ионов протекает труднее, потому что от + оторвать - на много сложнее чем от 0.
Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается 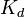 и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называютконстантой ионизации.
и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называютконстантой ионизации.
В общей реакции
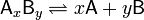
где комплекс 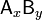 разбивается на x единиц A и y единиц B, константа диссоциации определяется так:
разбивается на x единиц A и y единиц B, константа диссоциации определяется так:
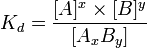
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
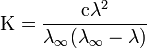
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
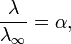
где α — степень диссоциации.
Закон разбавления Оствальда выведен В.Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теорииэлектролитической диссоциации.
 2018-01-21
2018-01-21 300
300






