Химическая символика
Современные символы химических элементов были введены в 1813 году Берцелиусом. Элементы обозначаются начальными буквами их латинских названий.
Например, кислород Oxygenium обозначаются буквой - О
сера Sulfur - S
водород Hydrogenium - H
углерод Carboneum - C
кальций Calcium - Ca
В химической литературе широко используются и групповые названия элементов.
Название группы элементов Элементы группы
гелий, неон, аргон, криптон, ксенон, радон
Благородные газы He, Ne, Ar, Kr, Xe, Rn
Галогены F, Cl, Br, I
Халкогены O, S, Se, Te, Pb
Щелочные элементы Li, Na, K, Rb, Cs, Fr
Щелочноземельные Ca, Sr, Ba, Ra
Лантоноиды элементы с порядковыми номерами (от La до Lu вкл.) 57-71
Актиноиды 89-103
Атом – наименьшая частица, элемента, обладающая его химическими свойствами.
При химическом взаимодействии атомов образуются молекулы.
→ одноатомные молекулы Hе
Молекулы → двухатомные N2, CO
→ многоатомные H2O C6H6
→ полимерные, до сотни тысяч атомов.
Состав и строение молекул определяют состояние вещества при выбранных условиях и их свойств
CO2 - газ, взаимодействует с водой
SiO2 - твердое вещество, HP в воде.
При химических явлениях молекулы разрушаются, но атомы сохраняются.
Стехиометрия химических превращений.
Стехиометрия - раздел химии, который рассматривает количественный состав веществ и количественные соотношения (массовые и объемные) между реагирующими веществами
Таблица 1
| Стехиометрия базируется на основных законах и понятиях | раздел ХИМИИ, который рассматривает количественный состав веществ и количественные соотношения (массовые и объемные) между реагирующими веществами | ||||||||||||||||||||
| |||||||||||||||||||||
| Закон сохранения массы (I) | Масса веществ, вступивших в реакцию, равна массе веществ, образующихся в результате реакции, например: t Cи (OH)2 = CиO + H2O Молекулярная масса, а.е.м. → 97,5 79,5 18 | ||||||||||||||||||||
| Закон постоянства состава (3) | Каждое химическое соединение независимо от способа его получения имеет постоянный элементный и массовый состав- t 2H2 + O2 = 2H2O (I); Cи(OH)2 = CиO + H2O (2) В молекуле H2O, полученной в реакции (I) и (2),отношение масс H: O = I: 7,84 (I: 8) | ||||||||||||||||||||
| Закон кратных отношений (4) | Если два элемента образуют друг с другом несколько химических соединений, то масса одного элемента, приходящаяся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа. |
Продолжение табл. 1
| Оксиды | N2O | NO | N2O3 | NO2 | N2O5 | |
| Cоотношение N: O | 28: | :16 | 14: 16 | 28:48 | 14:32 | 28:80 |
| Cоотношение на I атом | 14: | : 8 | 14: (2∙8) | 14: (3∙8) | 14: (4∙8) | 14: (5∙8) |
| Закон Авогадро(5) | Равные объемы газов, взятые при одной и той же температуре и одинаковом давлении, содержат одинаковое число молекул – (I) Число Авогадро NA – число структурных частиц в Na = 6,02∙1023моль-1 I моль вещества (2) I моль любого газа содержит одинаковое число молекул (при одинак. услов.) | |||||
| Закон эквива- лентов | Вещества вступают в химическое взаимодействие в массовых количествах, пропорциональных их химических эквивалентам:
Математическое выражение закона эквивалентов –
| |||||
| Основные понятия Моль Мольная масса Мольный объем Число моль | Моль – количество вещества, содержащее столько структурных единиц (моле-
углерода- I моль атомов углерода (12г) содержит – 6,02∙1023 атомов
МВЕЩ-ВА–масса I моль вещества, выраженная в граммах; МСаО = 56г; MH2SO4 = 98г | |||||
I моль любого вещества в газообразном состоянии при н.у. занимает – 22,4л (υ0) | ||||||
(I) по заданной массе вещества (2) в заданном объеме вещества в газо- и
n моль =  парообр.сост. n моль = парообр.сост. n моль = 
|
Продолжение табл. 1
| Эквивалент вещества Эквивалентная масса вещества (а) оксида (б)Гидроксида (в) Соли (г) Кислоты | ЭВ-ВА- такое его количество, которое содержится в I моль атомов водорода или замещает I моль атомов водорода в химических реакциях - масса I эквивалента вещества, выраженная в граммах, г / моль. | ||||||
ЭОКСИДА =  = = 
| |||||||
| Оксиды | N2O | MnO | MnO2 | MnO3 | Mn2O7 | ||
| Мольная масса, г / моль | |||||||
| Эквивалентная масса г/ моль | 
| 
| 
| 
| 
| ||
Э ГИДРОКСИДА =  = =  . .
| |||||||
| Уравнение реакций | Эквивалентная масса, г/моль | ||||||
| KOH + HCl = KCl + H2O | ЭКОН =  = 56 = 56
| ||||||
| Ca (OH)2 + 2HCl = CaCl2 +2H2O | Э  = =  = =  = 37 = 37
| ||||||
| Ca(OH)2 + HCl = CaOHCl + H2O | Э  = =  = = 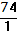 = 74 = 74
| ||||||
ЭСОЛИ =  ; Э К 2СО3 = ; Э К 2СО3 =  = 69 = 69
| |||||||
Э КИСЛОТЫ = 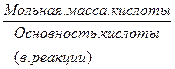 = = 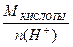 ; ;
| |||||||
| Эквива- лентный объем | Уравнение реакций | Эквиваленты кислот, г/моль | ||||||
| HCl + KOH = KCl + H2O | Э 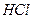 = M = M 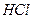 /I = 36,5/I = 36,5 /I = 36,5/I = 36,5
| |||||||
| H3PO4 + 2KOH = KH2PO4 + H2O | Э 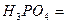 M M  /I = 98 /I = 98
| |||||||
| H3PO4 + 2 KOH = K2HPO4 + 2H2O | Э 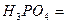 M M  /2 = 49 /2 = 49
| |||||||
| H3PO4 + 3 KOH = K3PO4 + 3 H2O | Э= M  /3 = 32,8 /3 = 32,8
| |||||||
| υ –экв. – объем, который занимает I эквивалент вещества в паро- и газо- образном состоянии при нормальных условиях (н.у.) | ||||||||
| Вещество | Мольн. объем | Мольн. масса | Валент. элемента | Эквивалент. масса г /моль | Число эквив. в моль | Эквивалент. объем, л. | ||
| H2, H-H Cl2, Cl-Cl O2, O-O N2, N-N | 22,4 22,4 22,4 22,4 | 1/ 1 = 1 35,5/1 = 35,5 16,0/2 = 8 14,0/3 = 4,67 | 4 (32: 8) 6,09 | 11,2 11,2 5,6 (22,4: 4) 3,2 | ||||
Например;
I моль (H2) с мольной массой 2г занимает 22,4 л. и содержит 2 экв. (H)
υЭКВ (H2) =  = 11,2; υэкв. ─ Iэкв. = 11,2; υэкв. ─ Iэкв.
| ||||||||
| Число эквивалентов (расчет) | (I) по заданной массе вещества (г) (2) в заданном объеме вещества в газо- и парообразном состоя- -нии |
nЭКВ.=  (I)
(I)
| n ЭКВ. =   (2)
(2)
| ||
| Закон эквивалентов (частное выражение) | Записывается в виде следующих соотношений, если один из участников реакции находится в газо-парообразном состоянии при н.у. (нормальные условия) | ||||
| Закон экв-тов | 
| 
| 
| ||
| Вещество | Кислород (O2) | Водород (H2) | Вещество в газообраз- ном состоянии | ||
| Решение Задачи | Найти число моль, экв. и объем водорода, образуемого при взаимодействии 0,45 г. металла с соляной кислотой при температуре
(- 30С) и давлении 800 мм. рт. ст.
Решение: (I) Используя частное выражение закона Эквивалентов, находим объем водорода, образующейся в реакции при н.у.
(2) Число моль и эквивалентов водорода, Содержащихся в 0,56 л Найти: 𝒏моль(H2) = 𝒏экв. =? υ (H2) =? 𝒏моль =? (3) Объем водорода, образующийся в реакции при температуре -3оС 800 мм. рт. ст., рассчитываем, используя уравнение Клайперона
| ||||
Атомная единица массы
В 1961 г. 1.а.е.м. = m( C) ∕ 12 = 1,6606 10-27кг
C) ∕ 12 = 1,6606 10-27кг
Относительной атомной массой элемента (сокращенно атомной массой) называют отношение средней массы атома при его природном изотопном составе к 1∕12 массы атома изотопа углерода.  C
C
о.а.м. – Ar безразмерная величина приведена в таблице, периодическая система элементов Д.И. Менделеева.
Mr – относительная молекулярная масса вещества
- отношение средней массы вещества, определенного состава, включающего атомы отдельных элементов в их природном изотопном составе к 1∕12 массы атома изотопа углерода
 (12-массовое число)
(12-массовое число)
Молярная масса – величина, равная отношению массы вещества к количеству вещества.
[ Mr (H2O) = 2,99 ∙10-26 кг. ∕ 6,02 ∙1023 1∕ моль = 0,18кг∕моль]
Mв = 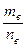


В одном моле любого вещества содержится одинаковое число структурных единиц, т. е. молярная масса вещества пропорциональна массе соответствующей структурной единицы, т. е. относительной молекулярной или атомной массе данного вещества. Mв = K· Mr (K = 1г∕моль).
Способы выражения концентрации раствора
Концентрация раствора – это содержание растворенного вещества в опреде-ленном массовом или объемном количестве раствора.
1. Процентная концентрация – содержание количества вещества в граммах в 100 гр. раствора.
- отношение массы растворенного вещества к массе раствора выраженное в %. V –[мл]
C% =  ∙ 100% m2 = V∙ ρ, ρ – [г∕см3]
∙ 100% m2 = V∙ ρ, ρ – [г∕см3]
2. Молярная концентрация – число молей растворенного вещества в 1 л. раствора.
СМ =  [
[ 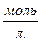 ] См =
] См =  n =
n =  [моль]
[моль]
3. Нормальная концентрация - показывает сколько грамм – эквивалентов растворенного вещества содержится в 1 литре раствора.
СН = 
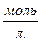 V – [л]
V – [л]
4. Моляльная концентрация – число моль растворенного вещества, содержащиеся в 1000 г. растворителя.
Cm =  m1, m2 - [ г]
m1, m2 - [ г]
5. Мольная доля (N) – отношение числа моль растворенного вещества (или растворителя) к общему числу моль всех веществ, находящихся в растворе.
N1 = n1/ (n1 + n2)
число моль растворенного вещества
N2 = n2/ (n1 + n2)
число моль растворителя
 2017-11-01
2017-11-01 253
253







 6. Закон эквивалентов
6. Закон эквивалентов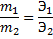

 л.
л. = 0,025; 𝒏экв.(H2) =
= 0,025; 𝒏экв.(H2) =  = 0,05
= 0,05 ; υ(Н2) =
; υ(Н2) = 







