Задание
1. Технологические показатели качества воды.
Решите задачу. Считая, что в воде содержаться, только соли  и
и  рассчитайте:
рассчитайте:
а) солесодержания и рН исходной воды;
б) массу осадка после термического умягчения воды;
в) количество реагентов, необходимых для умягчения воды методом осаждения (расчет вести на 100% - ные растворы умягчающих реагентов);
г) солесодержания и рН воды после Na-катионирования;
д) солесодержания и рН воды после Н-катионирования;
е) солесодержания и рН воды после Н-катионирования и ОН-анионирования.
Технологические показатели качества воды
В зависимости от характера использования воды различными потребителями определяются и показатели, необходимые для качественной и количественной характеристики воды. Важнейшими показателями качества воды для использования ее в теплоэнергетике являются:
1) концентрация грубодисперсных веществ (ГДП);
2) концентрация истинно растворенных примесей (ионный состав);
3) концентрация коррозионно-активных газов;
4) концентрация ионов водорода;
5) технологические показатели, в которые входят сухой и прокаленный остаток, окисляемость, жесткость, щелочность, кремнесодержание, удельная электропроводимость и т. д.
Концентрация грубодисперсных веществ в воде может быть достаточно точно определена фильтрованием воды через бумажный фильтр с последующим его высушиванием при температуре 378-383 К до постоянной массы. Однако на практике предпочитают использовать методы определения грубодисперсных веществ по прозрачности и мутности воды.
Прозрачность воды определяют при повышенных концентрациях ГДП в воде при помощи стеклянной трубки, залитой водой, на дне которой расположен шрифт или крест с шириной линий 1 мм. Высота столба воды, при которой определяется хорошая видимость шрифта или креста, является количественной оценкой прозрачности воды. При малых концентрациях ГДП (<3 мг/кг) используют нефелометрический метод, основанный на сравнении мутности анализируемой воды с соответствующим эталоном. Концентрация ГДП может быть также определена по разности значений плотного и сухого остатков, полученных при упаривании 1 кг соответственно не фильтрованной и фильтрованной воды.
Сухой остаток позволяет косвенно судить о солесодержании воды, т. е. о сумме всех анионов и катионов в воде, за исключением ионов Н+ и ОН-. Однако при образовании сухого остатка несколько изменяется ионный состав примесей за счет разложения бикарбонатов. В сухой остаток входит также часть органических и коллоидных примесей. Прокаливание сухого остатка при 1073 К приводит к сгоранию органических примесей и распаду карбонатов. Поэтому разность значений плотного и сухого остатков позволяет лишь ориентировочно оценить концентрацию.
Органических примесей в воде. На практике предпочитают определять концентрацию органических примесей в воде косвенным методом, используя сильные окислители (например, КМпО4). Поэтому концентрацию органических примесей называют окисляемостью воды и выражают через расход окислителя, необходимого в стандартных условиях для окисления органических примесей, содержащихся в 1 кг воды.
Концентрации отдельных ионов в воде, мг/кг (или мг-экв/кг), определяют методами химического анализа. Правильность проведения анализа должна подтверждаться выполнением закона электронейтральности мг-экв/кг. Возможная ошибка при этом не должна превышать 1%:

Если ошибка превышает 1%, то следует проверить качество анализа отдельных ионов или повторить весь анализ.
Суммарная концентрация всех катионов и анионов в воде составляет солесодержание воды, при этом не учитываются анионы кремниевой кислоты из-за неопределенности сведений об их концентрации в ионной форме, полуторные оксиды и ионы Н+ и ОН-. В случае крепких растворов ионы Н + и ОН- следует учитывать при подсчете солесодержания.
Жесткость воды является одним из важнейших показателей, определяющих пути использования воды в теплоэнергетике. Общей жесткостью воды Жо называется суммарная концентрация ионов кальция и магния, выражаемая в мг-экв/кг, а при малых значениях - в мкг-экв/кг. По определяющему катиону общая жесткость воды подразделяется на кальциевую ЖСа и магниевую ЖMg. Часть общей жесткости, эквивалентная концентрации бикарбонат ионов и карбонат ионов в воде, называется карбонатной жесткостью Жк, а остальная часть, эквивалентная содержащимся в воде другим анионам (С1-,SO4 и др.), называется некарбонатной жесткостью Жик:

Общей щелочностью воды Що, мг-экв/кг, называется суммарная концентрация всех анионов слабых кислот и ионов гидроксила за вычетом концентрации ионов водорода:

Характер анионов слабых кислот, обусловливающих общую щелочность, позволяет подразделять ее на гидратную щелочность (равную концентрации ионов ОН-), бикарбонатную (НСОз), карбонатную (СОз), силикатную (HSiO4, SiO3) и фосфатную (Н2РО4, НРО4, РО4).
Обычно в природных водах бикарбонатная щелочность, существенно преобладает над другими видами щелочности, поэтому ее значение без большой погрешности выражает общую щелочность воды. Поправка на концентрацию ионов Н+ при определении щелочности вводится при присутствии в воде слабых кислот в свободном состоянии, так как при их диссоциации образуются в эквивалентных количествах анионы слабых кислот и анионы Н +.
Удельная электропроводимость воды, См/см, характеризуется электрической проводимостью слоя воды, находящегося между двумя противоположными гранями куба с ребром, равным 10-2 м. Она косвенно связана с суммарной концентрацией примесей в истинно-растворенном состоянии (солесодержанием). В чистой воде, не содержащей примесей, перенос зарядов осуществляется лишь ионами Н+ и ОН-. Удельная электропроводимость такой воды при 293К составляет 0,04 мкСм/см. В растворах связь между электропроводимостью и концентрацией ионных примесей зависит от множества факторов, в том числе от температуры, вида ионов, степени диссоциации, что существенно затрудняет измерения. Более определенная связь существует в растворах при постоянной температуре и степени диссоциации. катионирование умягчение вода солесодержание
Концентрация растворенных газов в воде зависит от множества факторов: природы газа, температуры воды, степени минерализации воды, парциального давления газа над водой, рН воды и т. п. Это во многих случаях существенно затрудняет их аналитическое определение в технологических процессах и требует специальных методов анализа. Концентрация СО2 в природной воде существенно зависит от степени углекислотного равновесия и составляет примерно 0,5 мг/кг (105 моль/кг) при 293 К. Концентрация О2 в значительной степени зависит от содержания в воде органических веществ и температуры. При увеличении температуры от 273 до 308 К концентрация кислорода в чистой воде уменьшается от 14,6 до 6,5 мг/кг.
Окисляемость в некоторой мере характеризует загрязненность воды органическими веществами. Она обычно выражается количеством миллиграммов кислорода, потребных для окисления в определенных условиях органических веществ, содержащихся в 1 кг исследуемой воды, и обозначается мг/кг О2. Окисляемость не отвечает (не идентична) содержанию в воде органических веществ, так как при условиях ее определения не происходит полного разрушения (окисления) всех органических веществ. Окисляемость может быть выражена также количеством мг/кг КМпО4, израсходованного на окисление органических веществ.
Под кремнесодержанием понимается концентрация кремниевой кислоты (кремнекислоты, H2SiO3) в пересчете на двуокись кремния (SiO2), находящуюся в исходной воде. Присутствие SiO2 в питательной воде котельных агрегатов, особенно давлением 4,0 МПа и выше, при некоторых условиях приводит, как показывает опыт, к ряду затруднений в эксплуатации: образуются силикатные накипи, обладающие низкой теплопроводностью; возникает занос проточной части турбин аналогичными соединениями. Поэтому технология обработки исходной воды нередко включает и процесс ее частичного или полного обескремнивания. В настоящее время обескремнивание исходной воды производится с использованием ионитов.
Концентрация SiО2 в природных водах изменяется в широких пределах (от 5-10 до 90 мг/л). Она уменьшается с увеличением солесодержания (минерализации) воды. Маломинерализованные воды северных районов СНГ, как правило, содержат высокие концентрации кремнекислоты.
В исходных природных водах кремнекислота находится как в ионном (HSiO3), так и в коллоидном состоянии. Это обстоятельство усложняет задачу обескремнивания и химического контроля водного режима котельных агрегатов, так как при ионообменных процессах и химическом контроле в реакцию вступает только ионодисперсная форма кремнекислоты, что следует иметь в виду.
Решение задачи
Дано:
Ж0=1,5 ммоль-экв/л
Жнк=0,8 ммоль-экв/л
V=25 м3 =25000 л
а) Солесодержания и рН исходной воды.
Солесодержания - суммарная концентрация растворенных в воде солей.

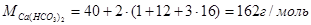

 ЖкVMэ=0,7*25*81=1417 г
ЖкVMэ=0,7*25*81=1417 г
 ЖнкVMэ=0,8*25*55,5= 1110 г
ЖнкVMэ=0,8*25*55,5= 1110 г
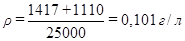
Соль  образована сильным основанием и сильной кислотой. Её раствор в воде имеет нейтральную реакцию среды рН=7.
образована сильным основанием и сильной кислотой. Её раствор в воде имеет нейтральную реакцию среды рН=7.
Соль  образованная сильным основанием
образованная сильным основанием  и слабой кислотой
и слабой кислотой  при растворении в воде подвергается гидролизу
при растворении в воде подвергается гидролизу

Константа равновесия этого процесса, помноженная на молярную концентрацию воды, называется константой гидролиза соли. Её можно вычислить по формуле:
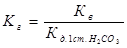
где Кв=10-14 - ионное произведение воды;  - константа диссоциации
- константа диссоциации  по 1-ой ступени.
по 1-ой ступени.

Уравнения диссоциации соли бикарбаната кальция

Исходная концентрация ионов  :
:
 2m/(MV)=2*1417/(162*25000)= 6,998*10-4моль/л
2m/(MV)=2*1417/(162*25000)= 6,998*10-4моль/л
Определим степень гидролиза соли 



 основная реакция среды
основная реакция среды
б) Масса осадка после термического умягчения воды
При термическом умягчении воды происходит снижение карбонатной жесткости в соответствии с реакцией
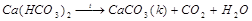
Массу образовавшегося карбоната кальция  можно определить по закону эквивалентов:
можно определить по закону эквивалентов:

Молярная масса 


Тогда 
Определим, сколько  растворяется в 25000 л воды
растворяется в 25000 л воды
 произведение растворимости.
произведение растворимости.
 моль/л
моль/л
Предельная масса растворенного в 25000 л воды  :
:
 г
г
Таким образом, в осадок при термическом умягчении воды выпадает:
 г
г
Остаточная жесткость воды равна некарбонатной жесткости т.е.
 ммоль-экв/л
ммоль-экв/л
в) Количество реагентов, необходимых для умягчения воды методом осаждения (расчет вести на 100% - ные растворы умягчающих реагентов)
Умягчения воды методом осаждения - это обработка воды химическими реагентами содой и известью. В результате образуются трудно растворимые вещества  и
и  выводимые в дальнейшем фильтром.
выводимые в дальнейшем фильтром.
) При добавления в воду извести снижается карбонатная жесткость воды.
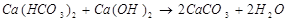
2) При добавления в воду соды снижается некарбонатная жесткость воды
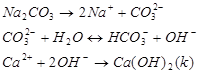
Массу использованных реагентов можно определить по закону эквивалентов:

Молярные массы эквивалентов реагентов


Определим массы реагентов для умягчения воды.

г) Солесодержания и рН воды после Na-катионирования
При Na - катионировании исходная вода пропускается через слой Na - катионита. При этом ионы Са+ из природной воды обмениваются на ионы Na+ из катионита:

Обмен происходит по закону эквивалентов т.е.
 или
или 
Молярные массы эквивалентов солей жесткости и солей натрия:

Тогда солесодержание Na - катионированной воды будет определяться содержанием в воде солей Na+

д) Солесодержания и рН воды после Н-катионирования
При Н - катионировании природная вода пропускается через слой Н - катионита. При этом katn+ из обрабатываемой воды обмениваются на ионы Н+ из катионита.

После полного Н - катионирования в обработанной воде практически не остается растворенных солей, т.е. солесодержание и жесткость становится близко к нулю:  и
и  . Однако обработанная вода в результате образовавшегося избытка ионов Н+ становиться более коррезионно-агресивной, так как уменьшается рН - среды
. Однако обработанная вода в результате образовавшегося избытка ионов Н+ становиться более коррезионно-агресивной, так как уменьшается рН - среды
Обмен катионов происходит по закону эквивалентов:
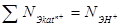
концентрация ионов Н+ в обработанной воде

Определим рН обработанной воды:
 среда кислая
среда кислая
е) солесодержания и рН воды после Н-катионирования и ОН-анионирования
При Н - катионировании и ОН - анионирования рН=7 т.к. остаются только Н+ и ОН-, они дают чистую воду 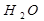 .
.

Солесодержание будет:

Список использованной литературы
1. Задачи и упражнения по общей химии. Под ред. Н.В. Коровина. М: Высшая школа,2006 - 255с.
2. Коровин Н.В. Общая химия. - М: Высшая школа, 2005.
3. Водоподготовка: процессы и аппараты. Громогласов А.А., Копылов А.С., Пильшиков А.П.
4. Водоподготовка. Белан Ф. И.
 2020-04-20
2020-04-20 104
104