30.04.2020
Урок №81
Группа ММС-5-18 ІІ курс
Профессия: младшая медицинская сестра по уходу за больными
Тема: Современные представления о строении атома.
Строение атома
В переводе с греческого языка, слово «атом» означает «неделимый». Однако, были открыты явления, которые демонстрируют возможность его деления. Это испускание рентгеновских лучей, испускание катодных лучей, явление фотоэффекта, явление радиоактивности. Электроны, протоны и нейтроны – это частицы, из которых состоит атом. Они называются субатомными частицами.
Таблица 1
| атом | ||
| ядро | электроны | |
| протоны | нейтроны | |
| p+ | no | e- |
| Масса протона | Масса нейтрона | Масса электрона |
| 1,0073 а.е.м. | 1,0087 а.е.м. | 0,0005 а.е.м. |
| Заряд протона | Заряд нейтрона | Заряд электрона |
| +1 | 0 | -1 |
Кроме протонов, в состав ядра большинства атомов входят нейтроны, не несущие никакого заряда. Как видно из табл. 1, масса нейтрона практически не отличается от массы протона. Протоны и нейтроны составляют ядро атома и называются нуклонами (nucleus – ядро). Их заряды и массы в атомных единицах массы (а.е.м.) показаны в таблице 1. При расчете массы атома массой электрона можно пренебречь.
Масса атома (массовое число) равна сумме масс, составляющих его ядро протонов и нейтронов. Массовое число обозначается буквой А. Из названия этой величины видно, что она тесно связана с округленной до целого числа атомной массой элемента.
A = Z + N
Здесь A – массовое число атома (сумма протонов и нейтронов),
Z – заряд ядра (число протонов в ядре),
N – число нейтронов в ядре.
Согласно учению об изотопах, понятию «химический элемент» можно дать такое определение:
Химическим элементом называется совокупность атомов с одинаковым зарядом ядра.
Некоторые элементы существуют в виде нескольких изотопов. «Изотопы» означает «занимающий одно и тоже место». Изотопы имеют одинаковое число протонов, но отличаются массой, т. е. числом нейтронов в ядре (числом N). Поскольку нейтроны практически не влияют на химические свойства элементов, все изотопы одного и того же элемента химически неотличимы.
Изотопы
Изотопами называются разновидности атомов одного и того же химического элемента с одинаковым зарядом ядра (то есть с одинаковым числом протонов), но с разным числом нейтронов в ядре.
Изотопы отличаются друг от друга только массовым числом.
Это обозначается либо верхним индексом в правом углу, либо в строчку: 12Сили С-12. Если элемент содержит несколько природных изотопов, то в периодической таблице Д.И. Менделеева указывается, его средняя атомная масса с учетом распространённости. Например, хлор содержит 2 природных изотопа 35Cl и37Cl, содержание которых составляет соответственно 75% и 25%. Таким образом, атомная масса хлора будет равна:
Аr(Cl)=0,75х35+0,25х37=35,5
Для тяжёлых искусственно-синтезированных атомов приводится одно значение атомной массы в квадратных скобках. Это атомная масса наиболее устойчивого изотопа данного элемента.
Основные модели строения атома
Исторически первой в 1897 году была модель атома Томсона.
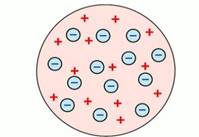
Рис. 1. Модель строения атома Дж. Томсона
Английский физик Дж. Дж. Томсон предположил, что атомы состоят из положительно заряженной сферы, в которую вкраплены электроны (рис. 1). Эту модель образно называют «сливовый пудинг», булочка с изюмом (где «изюминки» – это электроны), или «арбуз» с «семечками» – электронами. Однако от этой модели отказались, т. к. были получены экспериментальные данные, противоречащие ей.
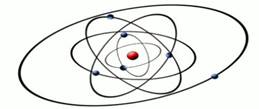
Рис. 2. Модель строения атома Э. Резерфорда
В 1910 году английский физик Эрнст Резерфорд со своими учениками Гейгером и Марсденом провели эксперимент, который дал поразительные результаты, необъяснимые с точки зрения модели Томсона. Эрнст Резерфорд доказал на опыте, что в центре атома имеется положительно заряженное ядро (рис. 2), вокруг которого, подобно планетам вокруг Солнца, вращаются электроны. Атом в целом электронейтрален, а электроны удерживаются в атоме за счет сил электростатического притяжения (кулоновских сил). Эта модель имела много противоречий и главное, не объясняла, почему электроны не падают на ядро, а также возможность поглощения и излучения им энергии.
Датский физик Н. Бор в 1913 году, взяв за основу модель атома Резерфорда, предложил модель атома, в которой электроны-частицы вращаются вокруг ядра атома примерно так же, как планеты обращаются вокруг Солнца.

Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. Почему это так, Бор в то время объяснить не мог. Но он показал, что такая модель (рис. 3) позволяет объяснить многие экспериментальные факты.
Радиоактивность — это способность атомов некоторых изотопов самопроизвольно распадаться, испуская излучение.
При радиоактивном распаде исходный атом превращается в атом другого элемента. В результате выбрасывания из ядра атома альфа-частицы, представляющей собой совокупность двух протонов и двух нейтронов, массовое число образующегося атома уменьшается на четыре единицы, и он оказывается сдвинутым в таблице Д. И. Менделеева на две клетки влево, так как порядковый номер элемента в таблице равен числу протонов в ядре атома. При выбрасывании бета-частицы (электрон) происходит превращение в ядре одного нейтрона в протон, вследствие чего образующийся атом оказывается сдвинутым в таблице Д. И. Менделеева на одну клетку вправо. Масса его при этом почти не изменяется. Выбрасывание бета-частицы сопряжено обычно с гамма-излучением.
Известно свыше 40 естественных радиоактивных изотопов. Большая часть их расположена в трех радиоактивных рядах (семействах): урана-радия, тория и актиния. Все указанные радиоактивные изотопы широко распространены в природе. Присутствие их в горных породах, водах, атмосфере, растительных и живых организмах обусловливает естественную или природную радиоактивность.
Кроме естественных радиоактивных изотопов, сейчас известно около тысячи искусственно радиоактивных. Получают их путем ядерных реакций, в основном в ядерных реакторах. Многие естественные и искусственно радиоактивные изотопы широко используются в медицине для лечения и особенно для диагностики заболеваний.
Превращения, при которых ядро одного химического элемента превращается в ядро другого элемента с другим значением атомного номера, называют радиоактивным распадом.
Радиоактивность была открыта в 1896 г. Беккерелем (А. Н. Becquerel), который обнаружил излучение урана, способное вызывать почернение фотоэмульсии и ионизировать воздух. Кюри-Склодовская (М. Curie-Sklodowska) первая измерила интенсивность излучения урана и одновременно с немецким ученым Шмидтом (G. С. Schmidt) обнаружила радиоактивность у тория.
После открытия радиоактивных элементов ряд авторов (Беккерель, супруги Кюри, Резерфорд и др.) установил, что эти элементы могут испускать три вида лучей, которые по-разному ведут себя в магнитном поле. По предложению Резерфорда (Е. Rutherford, 1902) эти лучи были названы альфа- (см. Альфа-излучение), бета- (см. Бета-излучение) и гамма-лучами (см. Гамма-излучение). Альфа-лучи состоят из положительно заряженных альфа-частиц (дважды ионизированных атомов гелия Не4); бета-лучи— из отрицательно заряженных частиц малой массы — электронов; гамма-лучи по природе аналогичны рентгеновым лучам и представляют собой кванты электромагнитного излучения и обладают наименьшей проникаемостью.
Радиоактивное вещество - вещество, содержащее радионуклиды и являющееся источником излучения. Радиоактивные вещества включаются в пищевые цепи и поражают живые организмы. Поражение организма может быть как индивидуальным (например, развитие злокачественных новообразований), так и генетическим, представляющим потенциальную опасность для здоровья будущих поколений. Радиоактивные вещества широко применяют в различных отраслях промышленности, а также в научно-исследовательских работах.
Ядерные реакции, превращения атомных ядер при взаимодействии с другими ядрами, элементарными частицами или γ-квантами. Такое определение разграничивает собственно ядерные реакции и процессы самопроизвольного превращения ядер при радиоактивном распаде (см. Радиоактивность), хотя в обоих случаях речь идет об образовании новых ядер.
Ядерные реакции осуществляют под действием налетающих, или бомбардирующих, частиц (нейтроны n, протоны р, дейтроны d, электроны е, ядра атомов различных элементов) либо γ-квантов, которыми облучают более тяжелые ядра, содержащиеся в мишени. Ядерная реакция может произойти, если две участвующие в ней частицы сближаются на расстояние, меньшее диаметра ядра (ок. 10-13 см), т. е. на расстояние, при котором действуют силы внутриядерного взаимодействия между составляющими ядра нуклонами. Если обе участвующие в ядерной реакции частицы – и бомбардирующая, и ядро мишени – заряжены положительно, то сближению частиц препятствует сила отталкивания двух положительных зарядов, и бомбардирующая частица должна преодолеть так называемый кулоновский потенциальный барьер. Высота этого барьера зависит от заряда бомбардирующей частицы и заряда ядра мишени. Для ядер, отвечающих атомам со средними значениями атомного номера, и бомбардирующих частиц с зарядом +1, высота барьера составляет около 10 МэВ. В случае, если в ядерной реакции участвуют частицы, не обладающие зарядом (нейтроны), кулоновский потенциальный барьер отсутствует, и ядерные реакции могут протекать с участием частиц, имеющих тепловую энергию (т. е. энергию, отвечающую тепловым колебаниям атомов).
Домашнее задание:
- выучить тему
- выполнить тесты
Тесты
| 1.β-излучение — это
| а) поток протонов |
| б) поток электронов | |
| в) поток ядер атома гелия | |
| г) поток нейтронов | |
| д) поток фотонов | |
| 2.Число нейтронов в ядре бериллия 94Ве равно | а) 2 |
| б) 5 | |
| в) 13 | |
| г) 4 | |
| д) 9 | |
| 3.Явление радиоактивности было открыто | а) английским химиком Ф. Содди |
| б) польским геохимиком М. Кюри | |
| в) английским физиком Э. Резерфордом | |
| г) французским исследователем А. Беккерелем | |
| д) американским биологом Т. Морганом | |
| 4.В ядрах атомов, кроме протонов, находятся
| а) нейтроны |
| б) фотоны | |
| в) позитроны | |
| г) электроны | |
| д) мезоны | |
| 5.В состав ядра входят: | а) Протоны и электроны |
| б) Нейтроны | |
| в) Электроны и нейтроны | |
| г) Протоны и нейтроны | |
| д) Протоны, нейтроны и электроны | |
| 6.Из трех типов излучений (α-β-γ) наименьшей проникающей способностью обладает | а) α-излучение |
| б) γ и β-излучение | |
| в) γ-излучение | |
| г) все три одинаково плохо проникает в вещество | |
| д) β -излучение | |
| 7. α -излучение — это | а) поток протонов |
| б) поток нейтронов | |
| в) поток электронов | |
| г) электромагнитное излучение | |
| д) поток ядер атома гелия |
Ответы на вопросы прислать на электронный адрес: swar65@mail.ru или в ВКонтакте
 2020-05-21
2020-05-21 176
176






