Химия_ТПО-1_Урок_71-72_
| Группа | № урока | Тема | Форма работы |
| ТПО-1 | 71 | Тема: Сущность метода нейтрализации, его индикаторы. Теория индикаторов | Лекция |
| 72 | Составить конспект по вопросам после материала. | Ответить на вопросы |
Тема: Сущность метода нейтрализации, его индикаторы. Теория индикаторов
Сущность кислотно-основного титрования (метод нейтрализации)
В основе кислотно-основного титрования лежит соединение ионов Н3О+ и гидроксид-ионов ОН – с образованием малодиссоциирующих молекул воды. В упрощенном виде
Н+ + ОН– = Н2О
Метод позволяет определять в растворах не только концентрацию кислот или оснований, но также и концентрацию гидролизующихся солей.
Для определения в растворах концентрации оснований или солей, дающих щелочную реакцию, используют в качестве титранта растворы кислот. Эти определения называют ацидиметрией (от лат. аcidum — кислота).
Концентрацию кислот и гидролитически кислых солей определяют с помощью титрантов растворов сильных оснований. Такие определения называют алкалиметрией (от лат. alkali – щелочь).
Поскольку реакция нейтрализации не сопровождается каким-нибудь внешним эффектом, к примеру изменением окраски раствора, точку эквивалентности определяют с помощью индикаторов.
Согласно ионной теории индикаторов Оствальда (1894ᴦ.), индикаторы в методе кислотно-основного титрования представляют собой такие слабые органические кислоты или основания, у которых недиссоциированные молекулы и ионы имеют различную окраску.
Индикаторы, обладающие свойством присоединять протоны, называют основными индикаторами и обозначают через IndOH, где Ind+ - катион индикатора. Такие индикаторы диссоциируют по схеме:
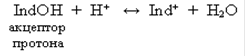
Индикаторы, обладающие свойством отдавать протоны, называют кислотными индикаторами и обозначают через HInd. Молекула такого индикатора играет роль донора протона, т. е. дает при диссоциации катион Н+ и анион Ind–:
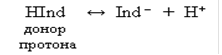
Все индикаторы изменяют свою окраску плавно в определенном интервале значений рН, называемом интервалом перехода, или зоной перехода окраски индикатора. Внутри зоны перехода имеется такое значение рН, при котором индикатор наиболее резко изменяет свою окраску. В данный момент концентрации молекулярной и ионной форм индикатора равны [HInd] = [Ind–]. Значение рН, при котором индикатор наиболее резко меняет свою окраску, принято называть показателем титрования (рТ).
В табл. 1 указаны область перехода, показатель титрования, окраска недиссоциированных молекул и анионов некоторых индикаторов.
Таблица1
Характеристики некоторых индикаторов
| индикатор | область перехода рН | показатель титрования рТ | окраска недиссоциированных молекул | окраска анионов |
| метилоранж | 3,1 — 4,0 | 4,0 | красная | оранжево-желтая |
| метилрот | 4,2 — 6,2 | 5,5 | красная | желтая |
| лакмус | 5,0 — 8,0 | 7,0 | красная | синяя |
| фенолфталеин | 8,0 — 10,0 | 9,0 | бесцветная | малиновая |
В случае если упрощенно обозначить молекулы фенолфталеина через HInd, а анионы его через Ind–, то уравнение диссоциации будет иметь вид
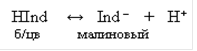
Достаточно к раствору, содержащему фенолфталеин, прибавить немного щелочи, как введенные ионы ОН– станут связывать протоны с образованием малодиссоциирующих молекул воды. При этом равновесие диссоциации индикатора сместится вправо и накопление анионов Ind– вызовет окрашивание раствора в малиновый цвет.
Наоборот, если к раствору фенолфталеина прилить несколько капель кислоты, то повышение концентрации протонов будет подавлять диссоциацию молекул индикатора. Равновесие сместится влево и раствор обесцветится. Аналогичным образом объясняют поведение лакмуса, молекулы которого окрашены в красный цвет, а анионы в синий; нейтральные растворы лакмуса имеют промежуточную фиолетовую окраску. Это подтверждает, что цвет водного раствора индикатора зависит от соотношения между его молекулярной и ионной формами.
Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, окраска молекул индикаторов, обладающих кислотными свойствами, проявляется в кислой среде, а окраска аниона — в щелочной.
В каждом конкретном случае кислотно-основного титрования индикатор подбирается таким образом, чтобы показатель титрования его как можно точнее совпадал с истинным моментом эквивалентности.
На правильный выбор индикатора влияет гидролиз солей, образующихся в процессе титрования.
Различают четыре случая выбора индикаторов.
1. Титрование сильного основания сильной кислотой (или наоборот)
К примеру: HCl + NaOH = NaCl + H2O
Соли катионов сильных оснований и анионов сильных кислот гидролизу не подвергаются, рН раствора 7, в связи с этим и момент эквивалентности будет при рН = 7. Для фиксирования момента эквивалентности в этом случае применяются любые индикаторы с рТ = 7 (к примеру, лакмус и др.)
2. Титрование сильной кислотой слабого основания
К примеру: HCl + NH4OH = NH4Cl + H2O
Образующаяся соль подвергается гидролизу: NH4+ + H2O ↔ NH4OH + H+
Среда раствора кислая, рН < 7, в связи с этим и момент эквивалентности будет при рН < 7. Для фиксирования момента эквивалентности применимы любые индикаторы с рТ < 7 (к примеру, метилоранж, метилрот и др.).
3. Титрование слабой кислоты сильным основанием
К примеру: CH3COOH + NaOH = CH3COONa + H2O
Образующаяся соль подвергается гидролизу: СН3СОО – + Н2О ↔ CH3COOН + OН –
Среда щелочная, рН > 7, в связи с этим и момент эквивалентности будет при рН > 7. Для фиксирования момента эквивалентности применимы любые индикаторы с рТ > 7 (к примеру, фенолфталеин и др.).
4. Титрование слабой кислоты слабым основанием (или наоборот)
К примеру: NH4OH + CH3COOH = CH3COONН4 + H2O
Такое титрование практически не применяется, т.к. соли катионов слабых оснований и анионов слабых кислот в растворах легко гидролизуются:
NH4+ + СН3СОО– + Н2О ↔ NH4OH + CH3COOН
В результате гидролиза образуются слабые электролиты, среда раствора остается практически нейтральной, рН = 7. Так как концентрации ионов Н+ и ОН– в растворе меняются незначительно, то они не оказывают существенного влияния на смещение индикаторного равновесия. В этом случае индикаторы свою окраску не изменяют, следовательно, слабые кислоты слабыми основаниями (или наоборот) точно не титруются.
Контрольные вопросы
1. Сущность кислотно-основного титрования (метод нейтрализации)
2. Что принято называть показателем титрования (рТ).
3. Какие случаи различают при выборе индикаторов
 2020-05-21
2020-05-21 418
418






