Общие способы получения металлов
Лабораторная работа № 7
Тема: «Закалка и отпуск стали. Ознакомление со структурами серого и белого чугуна.
Распознавание руд железа»
Смотреть по ссылке урок: https://www.youtube.com/watch?v=F6ApHPhpnok
!Записать всё в тетрадь для работ выполнить задание!
Цель: Ознакомление с образцами исходных материалов и продуктов чѐрной металлургии.
Оборудование: Коллекции «Чугун и сталь», магниты.
Краткая теория:
Важнейшими железными рудами являются:
Fe3O4 – магнетит (магнитный железняк) 72% Fe
Fe2O3 – гематит (красный железняк) 65% Fe
Fe2O3 х nH2O – лимонит (бурый железняк) 60% Fe
Fe2S – пирит (серный колчедан) 46,6% Fe
FeСO3 – сидерит (железный шпат) 35% Fe
В современной технике и в обыденной жизни применяются сплавы железа: чугун, сталь. Эти сплавы отличаются разным содержанием углерода. В чугуне углерода содержится от 1,7% до 5%, в стали – от 0,3% до 1.7%.
Для получения чугуна и стали перерабатываются железные руды, содержащие железо в виде оксидов, поэтому в основе химического получения чугуна лежит процесс восстановления железа из оксидов углеродом и оксидом углерода(II).
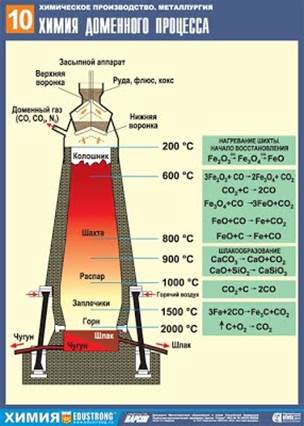
Процесс выплавки чугуна ведут в доменных печах. Доменная печь – сложное сооружение, высота которого 25 – 30 м, диаметр 6 – 8 м. Конструктивно домна имеет форму двух усечѐнных конусов, соединѐнных основаниями. Домна выложена из огнеупорного кирпича, снаружи покрыта стальным кожухом (для прочности). В домну сверху загружают шихту, которая состоит из чередующихся слоѐв руды, кокса, флюсов (плавни). Обогащѐнная руда содержит обычно 65 – 72% оксидов железа.
Кокс служит источником теплоты, является восстановителем, из него образуется оксид углерода (II), играющий роль восстановителя металла из руды. Кокс также нужен для науглероживания железа.
Флюсы (чаще всего известняк СаСО3) необходимы для вывода пустой породы в виде шлаков, состоящих главным образом из силикатов и алюмосиликатов кальция. Они предохраняют восстановленное железо от окисления и служат для понижения температуры плавления руды.
Снизу в домну подаѐтся смесь воздуха с кислородом или чистый кислород, предварительно нагретые до 600 – 8000С. Раскалѐнный уголь (кокс) реагирует с кислородом: С + О2 = СО2
Оксид углерода (IV) реагирует с раскалѐнным углѐм с образованием СО: СО2 + С = 2СО
СО восстанавливает железо из его оксидов по схеме: Fe2O3 → Fe3O4 → FeO → Fe
Свободное железо постепенно опускается вниз в зону более высоких температур, плавится и науглероживается, образуя карбид железа или цементит: 3Fe + С = Fe3С; 3Fe + 2СО = Fe3С + СО2
Так происходит образование чугуна. Находящиеся в руде примеси серы, фосфора, кремния, марганца восстанавливаются раскалѐнным коксом.
Восстановленные S, P, Si, Mn частично растворяются в расплавленном чугуне, частично уходят в шлак. Доменный процесс – непрерывный. Чугун и шлак периодически выпускают из печи через специальные желоба. Остановка доменной печи производится лишь раз в несколько лет для капитального ремонта. В доменных печах получают три вида чугунов: литейный, передельный, специальный.
 Литейный чугун содержит углерод в виде графита, используется для отливки чугунных изделий. Этот чугун называют ещѐ серым, так как на изломе он имеет серый цвет. Передельный чугун содержит углерод в виде цемента Fe3С, используется для переработки в сталь. Имеет ещѐ название белый чугун.
Литейный чугун содержит углерод в виде графита, используется для отливки чугунных изделий. Этот чугун называют ещѐ серым, так как на изломе он имеет серый цвет. Передельный чугун содержит углерод в виде цемента Fe3С, используется для переработки в сталь. Имеет ещѐ название белый чугун.
Специальные чугуны различаются содержанием С, P, Si, Mn. Используются для производства высококачественной стали, для изготовления конструкционных материалов в машиностроительной и приборостроительной промышленности.
Сырьѐм для получения стали служит передельный чугун, флюсы, металлолом. Процесс переработки чугуна в сталь сводится к удалению из него избытка
С, P, Si, Mn и других элементов. При высокой температуре кислород легко соединяется с углеродом и другими примесями, образуя оксиды. Оксид углерода (II) удаляется в виде газа, а остальные реагируют с флюсами, образуется шлак, всплывающий на поверхность стали.
По способам окисления примесей различают два конверторных процесса: бессемеровский и томасовкий, а также мартеновский и электротермический. Переделку чугуна в сталь ведут при температуре 18000С. Процесс плавки длится 5 -6 ч.
Контрольные вопросы:
1 Чем отличается чугун от стали.
2 Дайте определения следующим понятиям: закалка стали, отпуск стали.
3 Зарисовать схему доменного процесса.
Сделать вывод по работе:
Домашнее задание:
1. Осуществите переход: а) CuSO4 → FeSO4 ; б) CuSO4 → ZnSO4
2. Закончить уравнение реакции, написать уравнения электронного баланса: Сu + Hg(NO3)2→
3. Напишите уравнения реакции цинка с разбавленной азотной кислотой меди с концентрированной серной кислотой, рассмотрите их как окислительно-восстановительные, указав окислитель и восстановитель в этих реакциях с переходом электронов.
 2020-06-08
2020-06-08 117
117






