Определение жесткости воды
Определение жесткости воды было первым практически важным применением ЭДТА в аналитической химии. Жесткость воды характеризуют молярной концентрацией эквивалентов кальция и магния (fэ=1/2) и выражают в ммоль/л. Содержание этих элементов определяют прямым титрованием пробы воды в аммонийном буфере 0,01 М раствором ЭДТА в присутствии эриохром черного Т как индикатора и рассчитывают по формуле
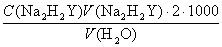 ,
,
где V(H2O) – объем воды, взятой для титрования, мл.
Тяжелые металлы предварительно осаждают в виде сульфидов или маскируют цианидом. Жесткость воды, обусловленную содержанием солей кальция, можно определить титрованием пробы с мурексидом в щелочной среде и далее по разности рассчитать жесткость, связанную с присутствием солей магния. Титрованию Mg2+ и Ca2+ не мешает большое содержание NaCl, поэтому кальций и магний можно комплексонометрически определять в морской воде.
Определение кальция и магния в различных растворах и материалах
На результаты комплексонометрического титрования Mg2+ и Ca2+ в аммонийном буфере с эриохром черным Т не влияет содержание сахара, поэтому метод используют для определения этих элементов в различных соках на предприятиях пищевой промышленности. Комплексонометрически определяют кальций и магний в технологическом контроле на предприятиях бумажной промышленности. При анализе известняка, доломита, магнезита, силикатов, цементов, руд и т.д. комплексонометрическое определение кальция и магния проводят после отделения кремниевой кислоты и оксидов других металлов. Большое практическое значение имеют быстрые комплексонометрические методы определения Mg2+ и Ca2+ в почвах, удобрениях, растительных и животных тканях, молоке, крови и т.д. Кальций в случае необходимости определяют титрованием в щелочной среде с мурексидом, а содержание магния рассчитывают по разности.
Комплексонометрический анализ сплавов, руд и концентратов
При комплексонометрическом анализе сложных объектов используют обычные приемы химического разделения (осаждение, ионный обмен, экстракция и т.д.) и маскировки (цианидом, фторидом, триэтаноламином и другими реагентами), но почти все компоненты определяют комплексонометрическим титрованием. Например, при анализе сплавов цветных металлов, содержащих медь, свинец, цинк и алюминий (бронзы, латуни и т.д.), медь определяют иодометрически, а свинец и цинк – комплексонометрически после оттитровывания меди. Перед определением свинца цинк маскируют цианидом, образующим с ним прочные комплексы, алюминий – фторидом, и титрование выполняют в присутствии соли магния. Затем демаскируют цинк, связанный в цианидный комплекс, раствором формалина и титруют раствором ЭДТА.
Определение сульфата, фосфата и других анионов
Определение многих анионов основано на осаждении их малорастворимых соединений титрованным раствором какого-либо катиона, избыток которого затем оттитровывают комплексоном. Сульфат по этой методике определяют осаждением BaSO4 хлоридом бария и последующим комплексонометрическим титрованием избытка ионов Ba2+. Фосфат осаждают в виде MgNH4PO4, и оставшееся в растворе количество магния определяют комплексонометрически.
Анализ органических соединений
Общий подход к комплексонометрическому определению органических соединений состоит в количественном выделении анализируемого вещества в виде соединения с цинком или кадмием. После выделения можно комплексонометрически определить не вошедшее в реакцию количество ионов цинка или кадмия или найти их содержание в осадке. Например, уротропин (CH2)6N4 в различных препаратах определяют осаждением координационного соединения состава [Cd2(CH2)6N4](SCN)4 при добавлении к пробе тиоцианата кадмия. В фильтрате после отделения осадка определяют содержание кадмия с помощью комплексона.
Примеры расчетов
Пример 1
Определите молярную концентрацию, молярную концентрацию эквивалентов и титр раствора, содержащего в 1 л 8,4053 г безводного этилендиа- минтетраацетата натрия (ЭДТА), используемого при определении свинца(II).
Решение. Рассчитаем молярную концентрацию раствора ЭДТА:
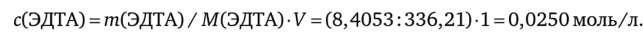
Рассчитаем молярную концентрацию эквивалентов ЭДТА. В основе комплексонометрического титрования свинца (II) лежит реакция
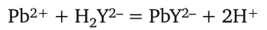
где H2Y2-— анион ЭДТА.
Из уравнения реакции следует, что эквивалентное число гэк(ЭДТА) = 2. Следовательно, молярная концентрация эквивалентов раствора ЭДТА в 2 раза больше его молярной концентрации:
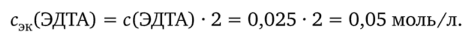
Рассчитаем титр раствора ЭДТА:

Пример 2
При определении железа (Ш) методом прямого комплексонометрического титрования приготовили 100 мл исходного анализируемого раствора, содержащего соль железа(Ш). Для анализа отобрали 20 мл приготовленного раствора, прибавили 4 мл 2 н. раствора НС1 и 20 мл воды. Раствор нагрели до 70—80 °С, прибавили несколько капель индикатора (25%-ного раствора сульфосалициловой кислоты) и оттитровали стандартным 0,025 н. раствором ЭДТА до изменения красно-фиолетового цвета титруемого раствора на желтый. На титрование израсходовано 18,50 мл раствора ЭДТА.
Рассчитайте молярную концентрацию, титр и массу железа (III) в исходном анализируемом растворе.
Решение. До прибавления титранта железо(Ш) образует с анионами индикатора (сульфосалициловой кислотой) комплекс красно-фиолетового цвета Fe(HInd)+, что упрощенно можно представить схемой
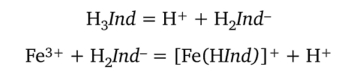
где Н 3Ind — сокращенное обозначение молекулы трехосновной сульфосалициловой кислоты (HInd- — бесцветный).
При прибавлении титранта образуется более устойчивый комплексонат железа(III) желтого цвета:
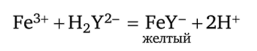
где H2Y2-— обычное сокращенное обозначение аниона ЭДТА.
После достижения ТЭ комплексом [Fe(H/nd)]+ полностью разрушается:
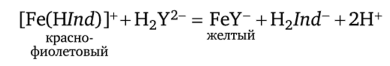
Окраска раствора изменяется от красно-фиолетовой до желтой.
1. Исходя из закона эквивалентов, рассчитаем молярную концентрацию железа(Ш) в анализируемом растворе:
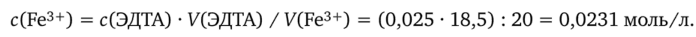
2. Вычислим титр T(Fe3+) в анализируемом растворе:
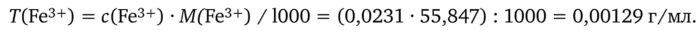
3. Рассчитаем массу m(Fe3+) железа(Ш) в исходном анализируемом растворе: 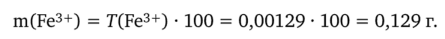
 2020-06-08
2020-06-08 105
105






