Урок: Строение атома. Планетарная модель атома.
Наиболее точный способ определения структуры любого вещества - это спектральный анализ. Излучение у каждого атома элемента исключительно индивидуальное. Однако, прежде, чем понять, каким образом происходит спектральный анализ, разберемся, какую структуру имеет атом любого элемента.
Развитие взглядов на строение атома.
Планк пришёл к гипотезе, что атомы могут излучать и поглощать энергию света только порциями. Но гипотеза Планка не раскрывала, ни закономерностей взаимодействия света с атомами, ни закономерностей их строения.
О том, что вещество состоит из частиц, знали давно. Около 420 г. до н.э. греческий учёный, философ Демокрит поддержал гипотезу о том, что материя состоит из крошечных неделимых частиц. По-гречески atomos означает «неделимый», поэтому эти частицы назвали атомами. Долгое время считали атом неделимой частицей.
Вторым рождением атомов человечество обязано английскому учёному Джону Дальтону. Он проводил опыты с газами и изучал пути их соединения. Учёный обнаружил, что кислород и водород, образуя воду, всегда соединяются в одних и тех же пропорциях по массе, исходя из этого, он сделал вывод, что вещества состоят из атомов, атом неделимая частица – твёрдый шарик, который переходит от одной молекулы к другой в ходе химических реакций. То, что вещество состоит из атомов, было доказано. Оставалась неясной внутренняя структура атома. Первые экспериментальные результаты, из которых можно было сделать вывод о сложной структуре атома, о наличии внутри атомов электрических зарядов были получены Майклом Фарадеем в 1833 году при изучении законов электролиза.
Первый шаг в данном направлении сделал английский физик Джозеф Джон Томсон. В 1897 году он доказал, что катодные лучи – не что иное, как потоки отрицательно заряженных частиц. Так был открыт электрон.
В 1903 – 1904 годах появились публикации о строении атома, принадлежащие одна японскому физику Хантаро Нагаока, другая английскому физику Джозефу Джону Томсону.
Нагаока представил строение атома аналогичным строению Солнечной системы: роль Солнца играет положительно заряженная центральная часть атома, вокруг которой по кольцеобразным орбитам движутся «планеты» - электроны.
Томсон высказал предположение, что атом может быть похож на рождественский пудинг, в котором большая, но лёгкая по массе положительна заряженная сфера радиусом r = 10-10м, усеяна отрицательно заряженными частицами.
В 1905 году В. Вин выступил на съезде немецких естествоиспытателей в Мюнхене с докладом об электронах. Он говорил, что проще было бы понимать каждый атом как планетарную систему. Но такая система не может быть устойчивой, так как электроны излучают энергию. Поэтому учёные вынуждены обратиться к системе, в которой электроны находятся в относительном покое. Такой статической моделью был атом Томсона.
Первое предположение о строении атома было представлено Дж. Томсоном. Этот ученый длительное время занимался изучением атомов. Более того, именно ему принадлежит открытие электрона - за что он и получил Нобелевскую премию. Модель, что предложил Томсон, не имела ничего общего с действительностью, однако послужила достаточно сильным стимулом в изучении строения атома Резерфордом. Модель, предложенная Томсоном, называлась "пудингом с изюмом".
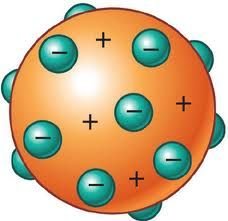
Томсон считал, что атом является сплошным шаром, имеющим отрицательный электрический заряд. Для его компенсации в шар вкраплены электроны, как изюминки. В сумме заряд электронов совпадает с зарядом всего ядра, что делает атом нейтральным.
ВО время изучения строения атома выяснили, что все атомы в твердых телах совершают колебательные движения. А, как известно, любая двигающаяся частица излучает волны. Именно поэтому каждый атом имеет свой собственный спектр. Однако данные утверждения никак не вкладывались в модель Томсона.
Опыт Резерфорда
Чтобы подтвердить или опровергнуть модель Томсона, Резерфордом был предложен опыт, в результате которого происходила бомбардировка атома некоторого элемента альфа-частицами. В результате данного эксперимента было важно увидеть, как будет вести себя частица.
Альфа частицы были открыты в результате радиоактивного распада радия. Их потоки представляли собой альфа-лучи, каждая частица которых имела положительный заряд. В результате многочисленных изучений было определено, что альфа-частица походит на атом гелия, в котором отсутствуют электроны. Используя нынешние знания, мы знаем, что альфа частица - это ядро гелия, в то время Резерфорд считал, что это были ионы гелия.
Каждая альфа-частица имела огромную энергию, в результате чего она могла лететь на рассматриваемые атомы с высокой скоростью. Поэтому основным результатом эксперимента являлось определение угла отклонения частицы.
Для проведения опыта Резерфорд использовал тонкую фольгу из золота. На нее он направлял высокоскоростные альфа-частицы. Он предполагал, что в результате данного эксперимента все частицы будут пролетать сквозь фольгу, причем с небольшими отклонениями. Однако, чтобы выяснить это наверняка, он поручил своим ученикам проверить, нет ли больших отклонений у данных частиц.
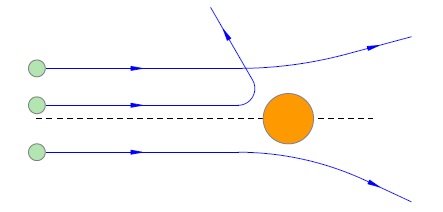
Результат эксперимента удивил абсолютно всех, ведь очень многие частицы не просто отклонились на достаточно большой угол - некоторые углы отклонения достигали более 90 градусов.
Данные результаты удивили абсолютно всех, Резерфорд говорил, что такое чувство, будто на пути снарядов был поставлен листок бумаги, который не дал альфа-частице проникнуть во внутрь, в результате чего, она повернулась обратно.
Если бы атом действительно был сплошным, то он должен был иметь некоторое электрическое поле, которое затормаживало частицу. Однако, сила поля была недостаточной, чтобы остановить её полностью, а уж тем более отбросить обратно. А это значит, что модель Томсона была опровергнута. Поэтому Резерфорд начал работать над новой моделью.
Модель Резерфорда
Чтобы получить такой результат эксперимента, необходимо сосредоточить положительный заряд в меньшем размере, в результате чего получится большее электрическое поле. По формуле потенциала поля можно определить необходимый размер положительной частицы, которая смогла бы оттолкнуть альфа-частицу в противоположном направлении. Радиус её должен быть порядка максимум 10-15 м. Именно поэтому Резерфорд предложил планетарную модель атома.
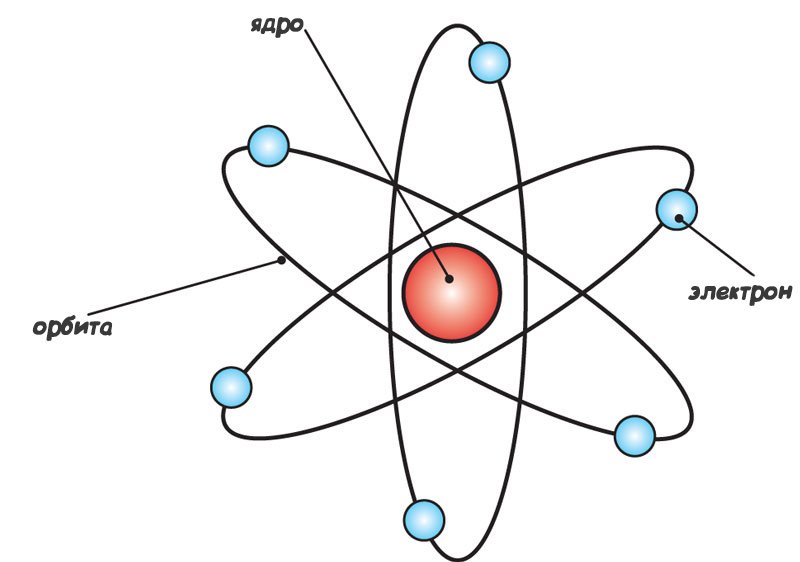
Данная модель названа так неспроста. Дело в том, что внутри атома имеется положительно заряженное ядро, подобное Солнцу в Солнечной системе. Вокруг ядра, как планеты вращаются электроны. Солнечная система устроена таким образом, что планеты притягиваются к Солнцу с помощью гравитационных сил, однако, они не падают на поверхность Солнца в результате имеющейся скорости, которая держит их на своей орбите. То же самое происходит и с электронами - кулоновские силы притягивают электроны к ядру, но за счет вращения они не падают на поверхность ядра.
Одно предположение Томсона оказалось абсолютно верно - суммарный заряд электронов соответствует заряду ядра. Однако в результате сильного взаимодействия электроны могут быть выбиты со своей орбиты, в результате чего заряд не компенсируется и атом превращается в положительно заряженный ион.
Очень важной информации относительно строения атома является то, что практически вся масса атома сосредоточена в ядре. Например, у атома водорода имеется всего один электрон, чья масса более, чем в полторы тысячи раз меньше, чем масса ядра.
Домашнее задание: вставьте в текст пропущенные слова (выделять красным цветом)
В конце ХХІ в. в составе атома были обнаружены заряженные частицы и перед учеными встала задача разработки электрической модели атома. Одной из первой моделей атома стала модель, предложенная английским ученым ______________. Атом, по предположению ___________ в целом электронейтрален. _______________ заряд, распределен по всему объему атома равномерно. Внутри _____________ заряда находятся ______________ заряженные частицы – электроны. Модель атома _____________ хорошо объясняла устойчивость атома и в этом было ее преимущество. В самом деле, при смещении заряда от положения равновесия, всегда возникает сила, стремящаяся вернуть этот заряд в положение равновесия. Любая теоретическая модель требует экспериментальной проверки. Для проверки электрической модели строения атома, предложенной _____________м, Э.Резерфорд провел опыты. Э.Резерфорд предложил применить зондирование атома с помощью?-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса?-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал?-частицы с кинетической энергией около 5 МэВ (скорость таких частиц очень велика – порядка 107 м/с, но она все же значительно меньше скорости света).?-частицы – это полностью ионизированные атомы гелия. Они были открыты Резерфордом в 1899 году при изучении явления радиоактивности. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.).
Как должны себя вести альфа-частицы в атоме Томпсона? Заряды в атоме Томпсона перемешаны. Поэтому электрическое поле внутри атома будет ____________. И оно ___________ вызвать заметного отклонения альфа – частицы от первоначальной траектории ее движения. Электроны также не могут вызвать заметного отклонения альфа-частицы от ее прежней траектории из-за ничтожной массы по сравнению с массой альфа-частицы. Поэтому, если модель атома Томпсона верна, рассеяние альфа-частиц должно происходить лишь на _________ углы.
Для исследования внутреннего строения атома была собрана установка, в которой от радиоактивного источника, заключенного в свинцовый контейнер,?-частицы направлялись на тонкую металлическую фольгу. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом с помощью микроскопа. Наблюдения рассеянных?-частиц в опыте Резерфорда можно было проводить под различными углами к первоначальному направлению пучка. Было обнаружено, что _______________?-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако ____________ часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие?-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Этот результат был совершенно неожиданным даже для Резерфорда. Он находился в резком противоречии с моделью атома Томсона, согласно которой ____________ заряд распределен по всему объему атома. При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить?-частицы назад. Электрическое поле однородного заряженного шара ____________ на его поверхности и убывает до нуля по мере приближения к центру шара. Если бы радиус шара, в котором сосредоточен весь положительный заряд атома, уменьшился в n раз, то максимальная сила отталкивания, действующая на?-частицу по закону Кулона, возросла бы в ______ раз. Следовательно, при достаточно большом значении n?-частицы могли бы испытать рассеяние на большие углы вплоть до 180°. Эти соображения привели Резерфорда к выводу, что атом почти ________, и весь его __________ заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал ____________. Так возникла ____________ атома.
Критерии оценки
Если пропустили
0-1 слова – отлично, молодцы
2-3 слова – хорошо, но надо быть внимательнее при чтении
4-5 слов – удовлетворительно, но умение и навыки работы с текстом вам надо развивать
Более 5 слов – к сожалению, вам надо серьёзно совершенствовать умение внимательно читать текст.
 2020-06-29
2020-06-29 726
726






