Амфотерные оксиды
| Способы получения | Химические свойства амфотерных оксидов |
| А) металл+ кислород Zn+O2→ZnO Б) разложение амфотерных оснований Zn(OH)2→ZnO+H2O В)разложение солей ZnCO3→ZnO+CO2 | 1)с кислотными оксидами ZnO+CO2→ZnCO3 2) со щелочами NaOН +ZnO→Na2ZnO2 + Н2О 3)с кислотами ZnO+HCI→ZnCI2+H2O 4) с основными оксидами Na2O +ZnO→Na2ZnO2 |
Гидроксиды (основания)
| Взаимодействие щелочей с некоторыми металлами (например, Al и Zn) | В растворе:
2Al + NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
При сплавлении:
2Al + 2NaOH + 2H2O 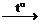 2NaAlО2 + 3H2. 2NaAlО2 + 3H2.
|
| Взаимодействие щелочей с кислотными и амфотерными оксидами | 2NaOH + СО2 = Na2CO3 + H2O
2NaOH + ZnO 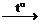 Na2ZnO2 + H2O Na2ZnO2 + H2O
|
| Взаимодействие оснований с кислотами: | H2SO4 + Ca(OH)2 = CaSO4¯ + 2H2O |
| Взаимодействие щелочей с амфотерными гидроксидами | 2NaOH + Zn(OH)2 =Na2[Zn(OH)4] |
| Взаимодействие щелочей с солями. В реакцию вступают соли, которым соответствует нерастворимое в воде основание: | 2NaOH + ZnSО4 ® Na2SO4 + Zn(OH)2¯ |
|
ПОЛУЧЕНИЕ | |
| Нерастворимые в воде основания получают путем взаимодействия соответствующей соли со щелочью: Zn2+ + 2OH–2® Zn(OH)2¯ | |
| Щелочи получают: 1) Взаимодействием оксида металла с водой: CaO + H2O ® Ca(OH)2. 2) Взаимодействием щелочных и щелочно-земельных металлов с водой: 2Na + H2O ® 2NaOH + H2 3) Обменным взаимодействием гидроксидов щелочно-земельных металлов с некоторыми солями. В ходе реакции должна обязательно получаться нерастворимая соль. Ba(OH)2 + Na2CO3 ® 2NaOH + BaCO3¯ | |
Химические свойства амфотерных гидроксидов.
| Как основания они взаимодействуют с кислотами и кислотными оксидами. Например: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O Zn(OH)2 + SO3 = ZnSO4 + H2O | Как кислоты они взаимодействуют со щелочами и основными оксидами. Например: Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O t Zn(OH)2 + CaO = CaZnO2 + H2O |
| Амфотерные гидроксиды, как и нерастворимые основания, при нагревании разлагаются. Например: t | |
Химические свойства кислот
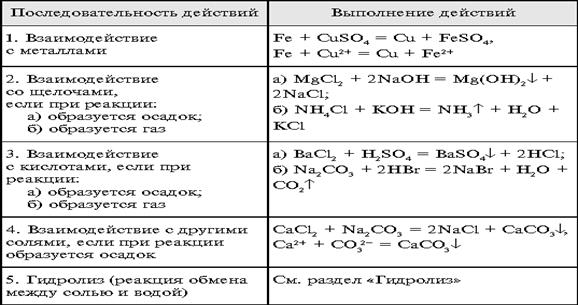
| ||
Получение кислот
|
Соли
- Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3
BaCO3 + 2HCl = BaCl2 + H2O + CO2 (H2CO3) - Растворимая соль + растворимая соль = нерастворимая соль + соль
Pb(NO3)2 + K2S = PbS + 2KNO3
СaCl2 + Na2CO3 = CaCO3 + 2NaCl - Растворимая соль + щелочь = соль + нерастворимое основание
Cu(NO3)2 + 2NaOH = 2NaNO3 + Cu(OH)2
2FeCl3 + 3Ba(OH)2 = 3BaCl2 + 2Fe(OH)3 - Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Zn + CuSO4 = ZnSO4 + Cu
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Важно:
1) металл (**) должен находиться в ряду напряжений левее металла (*),
2) металл (**) НЕ должен реагировать с водой.
 2020-08-05
2020-08-05 82
82 H2SO3.
2) При действии сильных кислот на соли более слабых или летучих кислородсодержащих кислот:
2HCl + Na2CO3 ® 2NaCl + Н2СО3
H2SO3.
2) При действии сильных кислот на соли более слабых или летучих кислородсодержащих кислот:
2HCl + Na2CO3 ® 2NaCl + Н2СО3







