Контрольные вопросы
1. Что называется титрованием?
2. Какая необходима посуда при титровании?
3. Как заполняются бюретки, пипетки, какие требования необходимо соблюдать?
4. Как выбирается индикатор для работы для работы при титровании?
5. Для чего применяется индикатор? В чем суть теории индикаторов?
6. Что называется скачком титрования, какой предел титрования растворов?
7. Химическая реакция, протекающая при титровании раствора HCl бурой.
8. Почему данный метод титрования называется методом нейтрализации?
9. Какая формула связывает любой процесс титрования?
10. Какой закон положен в основу количественного анализа?
11. Расчетные формулы нормальности, титра, фактора пересчета.
12. Что такое РН раствора и какова его роль при титровании по данному методу.
13. Дайте описание работы по условию титра раствора 0,1н HCl.
14. Техника безопасности при выполнении этой работы.
15. Суть прямого титрования. Как определяется метод титрования?
Лабораторная работа № 19
Определение содержания щелочи в растворе
Цель: Ознакомить с техникой анализа количественного определения веществ методом нейтрализации.
Посуда и реактивы: Колба мерная на 100мл., титрованный раствор 0,1н HCl соляной кислоты, бюретка, пипетка, колба коническая, фенолфталеин.
Задание: Выполните опыты, оформите отчет
Правила техники безопасности:
1.Правила работы с реактивами.
2.Правила работы с химической посудой.
Методические указания к выполнению лабораторной работы:
Кривая титрования сильной кислоты сильным основанием.
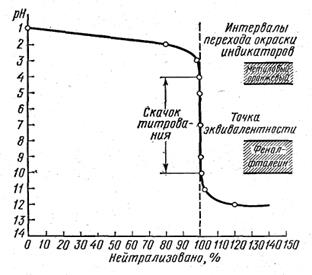
Химическая реакция:
NaOH + HCl = NaCl + H2О
Ход работы:
1. В колбу с контрольной задачей, доливаем воды до метки, перемешиваем.
2. По всем правилам заполняем бюретку титрованным раствором HCl.
3. Отбираем пипеткой точный объем контрольного раствора в коническую колбу, добавляем 1-2 капли фенолфталеина
Разраб.
Лит.
Листов
Пров.
Н. контр.
Утв.
4. Титрование производим до переходящей окраски от одной капли, из малиновой в бесцветную.
Результаты титрования заносим в таблицу:
| количество щелочи взятой для титрования, мл | нормальная концентрация кислоты, | количество кислоты пошедшей на титрование, мл |
5. Расчет:
Производим по среднему объему кислоты, пошедшему на титрование щелочи:

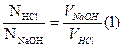
mNaOH = 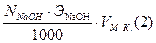
ПРИМЕЧАНИЕ: Можно при титровании исследуемый раствор залить в бюретку.
Контрольные вопросы
1. Какие особенности и в чем суть метода нейтрализации?
2. Для чего строится кривая титрования и что она собой представляет?
3. Что называется на графике линией нейтральности и эквивалентности?
4. Какие процентные соотношения выбираются титранта для построения кривой титрования?
5. Пример построения кривой титрования.
6. Реакция, протекающая при титровании.
7. Ход работы по определению щелочи в растворе.
8. Вычисление нормальности и массы щелочи, растворенной в растворе.
9. Техника безопасности, соблюдаемая при выполнении лабораторной работы.
10. Посуда и реактивы, необходимые для этой работы.
11. Что называется скачком титрования точкой скачка?
12. В какой среде возникает, скачет титрования?
Лабораторная работа № 21
Определение процентного содержания гидроксида натрия и карбоната натрия при совместном присутствии
Цель: Приобрести навыки титрования растворов, содержащих два
компонента.
Посуда и реактивы: Мерная колба с контрольным раствором, бюретка, пипетка, колба коническая, титрованный раствор HCl, фенолфталеин, метилоранж.
Задание: Выполните опыты, оформите отчет
Правила техники безопасности:
1.Правила работы с реактивами.
2.Правила работы с химической посудой.
Методические указания к выполнению лабораторной работы:
Метод основан на титровании раствора, содержащего смесь карбоната и гидрокарбоната натрия, раствором соляной кислоты в присутствии двух индикаторов, применяемых последовательно.
Уравнение реакции:
NaOH + Na2CO3 + 2HCl = 2NaCl + NaHCO3 + H2O (1стадия)
NaHCO3 + HCl = NaCl + СO2 + H2O (2 стадия)
2NaOH + Na2CO3 + 4HCl = 4NaCl + СO2↑ + 3H2O
Ход работы:
1. В колбу с контрольной задачей доливаем воды.
2. Бюретку заполняем титрованным раствором HCl.
3. Отбираем пипеткой аликвотную часть раствора в коническую колбу, добавляем фенолфталеин.
4. Титрование производим до переходящей окраски из малиновой в бесцветную.
5. Не доливаем бюретку. Добавляем в оттитрованный раствор метилоранж и титруем от желтой окраски до оранжево-розовой.
ПРИМЕЧАНИЕ:
При титровании с первым индикатором фенолфталеином по мере уменьшения интенсивности окраски раствора, скорость приливания титра уменьшить!
6. Результаты титрования записываем в таблицу:
Разраб.
Лит.
Листов
Пров.
Н. контр.
Утв.
Таблица
| концентрация НСl, | исследуемый объем, | объем НСl пошедший на титрование по ф-ф,V1,мл. | объем НСl пошедший на титрование по м-о,V2, мл. | для определения карбоната (V2- V1), | для определения щелочи V2-2 (V2- V1) |
7. Расчет:
А. Рассчитываем карбонат:
Nкарб. = 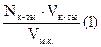 m карб. =
m карб. = 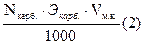
Б. Рассчитываем щелочь:
Nщ. = 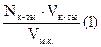 m щ. =
m щ. = 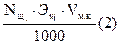
Контрольные вопросы
1. Почему и когда применяется при титровании 2-а индикатора?
2. Чем характерна теория индикатора фенолфталеина и метилоранжа?
3. Что будет представлять собой кривая титрования?
4. Сколько на графике будет скачков, и в какой среде?
5. Какой переход окраски предусматривается у фенолфталеина и метилоранжа?
6. Ход работы по определению щелочи и карбоната при совместном присутствии в растворе.
7. Техника безопасности соблюдаемая при работе.
8. Расчет нормальности и массы щелочи и карбоната по средним объемам.
9. Уравнение реакции, протекающей при титровании данной смеси; по стадиям и суммарное.
Лабораторная работа № 22
Приготовление стандартного раствора перманганата калия
Цель: Изучить окислительно-восстановительный метод титрования без применения индикатора.
Посуда и реактивы: Аналитические весы, часовое стекло, мерная колба, химический стакан, промывалка, дистиллированная вода, воронка.
Задание: Выполните опыты, оформите отчет
Правила техники безопасности:
1.Правила работы с реактивами.
2.Правила работы с химической посудой.
Методические указания к выполнению лабораторной работы:
Перманганатометрия - один из наиболее часто применяемых методов окислительно-восстановительного титрования. В качестве титранта используют раствор перманганата калия, окислительные свойства которого можно регулировать в зависимости от кислотности раствора.
Титрант КMnO4 готовят как вторичный стандарт, поскольку исходный реагент - перманганат калия - трудно получить в химически чистом состоянии.
Ход работы:
1. Вычисляем необходимое количество KMnO4, для приготовления раствора в определенном объеме:
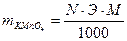
ЭKMnO4 = 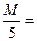
2. Взвешиваем на весах:
Вес часового стекла: А1=
Вес часового стекла с KMnO4: А2=
Навеска KMnO4 А3= А2 – А1
Разраб.
Лит.
Листов
Пров.
Н. контр.
Утв.
3. Приготовление раствора KMnO4:
Навеску KMnO4 растворяем в 50мл прокипяченной и охлажденной воды. Даем раствору отстояться, и сливаем в мерную колбу, доливаем водой. Приготовленный раствор отстаиваем не менее семи дней: с целью окисления органических примесей, образовавшийся MnO2 осядет на дно. Раствор можно приготовить также из фиксанала.
Контрольные вопросы
1. Какие особенности титрованного раствора перманганата калия, почему его необходимо готовить заранее?
2. Что представляет собой фиксанальная ампула?
3. Как готовиться титрованный раствор из фиксанала?
4. Какая при этом необходима посуда?
5. Как рассчитать необходимое количество перманганата калия для приготовления 200мл. 0,01н раствора?
6. Как на весах производить взвешивание перманганата калия?
7. Какая необходима дистиллированная вода и почему?
8. Для чего титрованный раствор фильтруется?
9. Ход работы по приготовлению титрованного раствора из отдельной навески.
10. Техника безопасности, соблюдаемая при выполнении работы.
11. Какая необходимая посуда при таком методе работы и приборы?
12. Какая точность взятия навески?
13. Хранение титрованного раствора.
Лабораторная работа № 23
Установление нормальности и титра раствора перманганата калия
по оксалату аммония
Цель: Углубить навыки титрования растворов окислительно-восстановительным методом. Стандартизировать раствор перманганата калия по оксалату аммонию.
Посуда и реактивы: Бюретка, пипетка, колба коническая, титрованный раствор оксалата аммония, 2н. H2SO4, водяная баня.
Задание: Выполните опыты, оформите отчет
Правила техники безопасности:
1.Правила работы с реактивами.
2.Правила работы с химической посудой.
3.Правила работы с нагревательными приборами.
Методические указания к выполнению лабораторной работы:
Для установки титра раствора KMnO4 предложено много различных стандартных веществ, например Н2С2O4·2Н2О, Na2С2O4, К4[Fе(СN)6]·3Н2О, Аs2O3, металлическое железо и т. п.
Оксалат аммония обладает некоторыми преимуществами по сравнению с другими установочными веществами: хорошо кристаллизуется и легко растворяется в воде, имеет определенный химический состав и не изменяется при хранении, не взаимодействует с кислородом воздуха и СО2
Уравнение реакции:
5(NH4)2C2O4 + 2KMnO4 + 8H2SO4 = 2MnSO4 + K2SO4 + 5(NH4)2SO4 +8H2O + 10CO2↑
Ход работы:
1. Бюретку заполняем титрованным раствором перманганата калия по правилу. Определение ведем по верхнему мениску!
2. Пипеткой отбираем точный объем раствора оксалата аммония.
3. Добавляем столько же мензуркой 2н. серной кислоты.
4. Коническую колбу нагреваем на водяной бане, не доводя до кипения.
5. Горячий раствор в конической колбе титруем раствором KMnO4.
6. Титрование прекращаем, когда в конической колбе раствор окрасится в бледно розовый цвет.
7. Результаты титрования записываем в таблицу.


Разраб.
Лит.
Листов
Пров.
Н. контр.
Утв.
Таблица
| Объем (NH4)2C2O4, мл | Сн(NH4)2C2O4, | Объем KMnO4,мл |
По среднему объему KMnO4 производим расчеты нормальности и титра раствора перманганата калия:
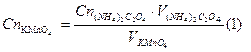
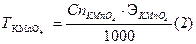
Кф- фактор пересчета, или поправочный коэффициент
Расчет:
Контрольные вопросы
1. Почему этот метод титрования называется окислительно-восстановительным?
2. Какова роль величины электродного потенциала в определении направления химической реакции процесса?
3. Почему здесь не применяется индикатор?
4. Почему серную кислоту необходимо лить в воду? Для чего она применяется в этой реакции? Напишите уравнение реакции.
5. Ход работы по определению титра перманганата калия.
6. Как рассчитать нормальность и титр раствора, фактор пересчета.
7. Техника безопасности, соблюдаемая при работе.
Лабораторная работа № 24
Определение железа в соли Мора
Цель: Углубить навыки титрования растворов окислительно-восстановительного метода. Определить наличие ионов Fe2+ в растворе соли Мора.
Посуда и реактивы: Колба с исследуемым раствором соли Мора, бюретка, пипетка, 2н. серная кислота, титрованный раствор перманганата калия, колба коническая, мензурка.
Задание: Выполните опыты, оформите отчет.
Правила техники безопасности:
1.Правила работы с реактивами.
2.Правила работы с химической посудой.
Методические указания к выполнению лабораторной работы:
Уравнение реакции:
10(NH4)2Fe(SO4)2 + 2KMnO4 + 8H2SO4 =
5Fe2 (SO4)3 + 2MnSO4 + K2SO4 + 10(NH4)2 SO4 + 8H2O
Соль Мора является двойной солью сульфатов железа (II) и аммония FeSO4 (NH4)2 SO4 ∙6H2 O. Так как сульфат аммония не участвует в реакции с перманганатом, то уравнение реакции взаимодействия можно написать только с FeSO4:
10 FeSO4 +2KMnO4 +8H2 SO4 =5Fe2 (SO4)3 +K2 SO4 +2MnSO4 +8H2 O
Ход работы:
1. Доливаем до метки контрольные раствор в мерной колбе, тщательно перемешиваем.
2. Заполняем бюретку титрованным раствором KMnO4.
3. Отбираем пипеткой из мерной колбы точный объем раствора в коническую колбу.
4. Добавляем в коническую колбу мензуркой столько же 2н. серной кислоты.
5. Производим титрование раствора титрованным раствором KMnO4 до устойчивой розовой окраски.
Разраб.
Лит.
Листов
Пров.
Н. контр.
Утв.
Результаты титрования записываем в таблицу:
| Объем исходного раствора, мл | Расход перманганата калия, мл | Сн, перманганата калия, |
По среднему значению титра рассчитываем нормальность, массу соли Мора, процентное содержание железа:
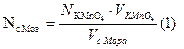
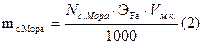
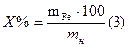
ІІ. Определяем железа методом отдельных навесок.
1. Навеску рассчитываем на объем выбранной пипетки.
2. Взвешиваем три навески на аналитических весах (по разности) и количественно переносим в конические колбы, которые надписаны.
3. В каждую колбу добавляем 30-40мл 2н. серной кислоты и примерно 20мл воды.
4. Титруем титрованным раствором KMnO4 до появления розовой окраски.
5. Титрование начинаем с колбы, где меньше навеска.
РАСЧЕТЫ: производим для каждой навески.
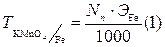
Масса железа в навеске составит:
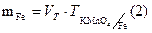
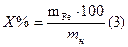
Контрольные вопросы
1. Что называется восстановителем, какова его роль в химической реакции.
2. Что представляет собой соль Мора? Особенности двойных солей.
3. Что представляет собой кривая титрования соли Мора перманганатом калия?
4. Можно ли проводить работу в других средах? Почему выбрали кислоту?
5. Написать уравнение химической реакции.
6. Ход анализа соли Мора.
7. Расчет титра, массы, и процентного содержания этими методами.
8. Техника безопасности соблюдаемая при работе.
9. В чем преимущество и недостаток этих двух методов?
Лабораторная работа № 25
Определение хрома в растворе
Цель: Ознакомиться с методом обратного титрования. Определить наличие ионов Cr3+ в растворе соли хрома.
Посуда и реактивы: Мерная колба с раствором бихромата калия, бюретка, раствор соли Мора, 2н. серная кислота, раствор перманганата калия.
Задание: Выполните опыты, оформите отчет.
Правила техники безопасности:
1.Правила работы с реактивами.
2.Правила работы с химической посудой
Методические указания к выполнению лабораторной работы:
Уравнение реакции:
K2Cr2O7 + 6FeSO4 + 7H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
2KMnO4 + 10FeSO4 + 8H2SO4 =2MnSO4 + K2SO4 +5Fe2(SO4)3 +8H2O
Ход работы:
1. Взвешиваем навеску бихромата калия и растворяем в мерной колбе.
2. Отбираем пипеткой исследуемый раствор бихромата калия из мерной контрольной колбы.
3. Подкисляем половинным объемом 2н. серной кислоты (1/2пипетки). Кислоту отмеряем мензуркой.
4. В ту же коническую колбу отмеряем из другой бюретки двойной объем соли Мора.
5. Избыток соли Мора титруем раствором перманганата калия до появления сероватой окраски.
Оттитровываем параллельно пипетку соли Мора, подкисленной 2н. раствором серной кислоты.
ПРИМЕЧАНИЕ: В том и другом случае титрование производим до 3-х сходящихся результатов.
По среднему значению сходящихся результатов рассчитываем содержание хрома в растворе (в %).
Результаты титрования записываем в таблицу:
Разраб.
Лит.
Листов
Пров.
Н. контр.
Утв.
Таблица
| объем бихромата калия, мл | Сн, перманганата калия, | объем соли Мора, мл | объем перманганата, мл |
Расчеты:
1. Навеску бихромата калия рассчитываем по формуле:
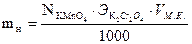
2. Определяем массу хрома в объеме мерной колбы: (Vм.к.)
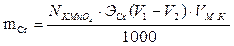
где:
V1 – объем перманганата калия, затраченного на титрование соли Мора без бихромата калия, мл
V2 – объем перманганата калия, затраченного на титрование соли Мора с бихроматом калия, мл
Vм.к. – вместимость мерной колбы, мл
Vн – вместимость пипетки, мл
СОДЕРЖАНИЕ ХРОМА: Х% = 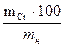
mн – масса хрома в растворе, г
Контрольные вопросы
1. Что называется окислителем? Его роль в химической реакции?
2. Что называется обратимым титрованием?
3. Расчеты при обратимом титровании.
4. Химическая реакция при данном титровании.
5. Ход работы по определению хрома данным методом.
6. Преимущества прямого метода титрования над обратным и наоборот.
7. Расчет массы хрома в растворе.
8. Определение процентного содержания.
9. Техника безопасности при выполнении данной работы.
10. Как меняется степень окисления восстановителя и окислителя в данной работе.
Лабораторная работа № 26
Определение нормальности раствора тиосульфата натрия по титрованному раствору перманганата калия
Цель: Приобрести навыки работы с тиосульфатом натрия
Посуда и реактивы: Промывалка, мерная посуда, бюретка, колбы, титрованный раствор KMnO4, раствор тиосульфата натрия, раствор йодида калия, 2н. серная кислота, крахмал.
Задание: Выполните опыты, оформите отчет.
Правила техники безопасности:
1.Правила работы с реактивами.
2.Правила работы с химической посудой
Методические указания к выполнению лабораторной работы:
Иодометрия -метод количественного объемного анализа, в основе которого лежит реакция восстановления свободного йода в йод-ион или окисления йод-иона в свободный иод. Направление реакции зависит от окислительной способности вступающих в реакцию с йодом веществ: например с Na2S2O3 реакция идет слева направо, с КМп04, К2Сг2О7-справа налево.
Уравнение реакции:
2KMnO4 + 10KI + 8H2SO4 = 5I2 ↓ +2MnSO4 + 6K2SO4 +8H2O
Ход работы:
1. В коническую колбу, наливаем последовательно пипеткой, точный объем титрованного раствора KMnO4, 30-40мл 2н. раствора серной кислоты и 15мл 10%-ного раствора KI.
2. Смесь выдерживают 2-3 мин., после чего добавляем 100-150мл воды.
3. Производим титрование тиосульфатом натрия сначала без индикатора до получения бледно-желтой окраски раствора, а затем, добавляем 2-3мл раствора крахмала, до полного обесцвечивания раствора.
Результаты титрования записываем в таблицу:
| Объем исходного раствора, мл | Расход тиосульфата натрия, мл | Сн, перманганата калия, |
|
| ||
Разраб.
Лит.
Листов
Пров.
Н. контр.
Утв.
Расчет:
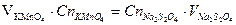
Контрольные вопросы
1. Какие стандартные растворы и какой индикатор, применяют в йодометрии?
2. Составить уравнение реакции между Na2S2O3 и I2. Какой окислительно-восстановительный процесс происходит при этом?
3. Чему равен грамм эквивалент Na2S2O3 в его реакции с йодидом?
4. Каким методом определяют нормальность растворов тиосульфата и йодида?
5. Как определяют содержание окислителей, методом йодометрии?
6. Как определяют содержание восстановителей методом йодометрии?
7. Почему при йодометрическом определении окислителей KI добавляют в избытке?
8. Почему перед титрованием кислых растворов тиосульфатом необходимо разбавлять их большим количеством воды?
Лабораторная работа № 27
Определение меди в растворе методом иодометрии
Цель: Ознакомиться с методом йодометрии, научиться определять медь (II) – окислитель, методом титрования заместителя, используя для фиксирования конечной точки титрования специфический индикатор крахмал. Определить массу меди в контрольном растворе.
Посуда и реактивы: Мерная колба с исследуемым раствором медного купороса, 2н. уксусная кислота, 25%-ного раствора KI, 0,1н. раствора тиосульфата натрия, 0,5%-ного раствора крахмала.
Задание: Выполните опыты, оформите отчет.
Правила техники безопасности:
1.Правила работы с реактивами.
2.Правила работы с химической посудой
Методические указания к выполнению лабораторной работы:
Определение меди (II) основано на реакции окисления йодида калия ионами Cu2+ и последующим титровании выделившегося йода раствором тиосульфата натрия. Этот метод определения относится к группе методов титриметрического анализа, называемых методами титрования заместителя. В данном случае медь замещается йодом.
Уравнение реакции:
2CuSO4 + 4KI = 2CuI + I2↓+ 2K2SO4
2Na2S2O3 + I2 = 2NaI + Na2S4O6
Ход работы:
1. Доводим полученный раствор в мерной колбе до метки.
2. Отбираем пипеткой точный объем исследуемого раствора в коническую колбу
3. Заполняем бюретку 0,1н. раствором тиосульфата натрия.
4. В коническую колбу добавляем 3-4мл. 2н. уксусной кислоты.
5. Производим титрование, после 5 минутного содержания конической колбы с содержимым в темном месте, накрыв колбу стеклом.
6. После окончания реакции содержимое в колбе оттитровываем раствором тиосульфата натрия.
Разраб.
Лит.
Листов
Пров.
Н. контр.
Утв.
7. Титрование производим до соломенной окраски раствора, не обращая внимание, на выпавший осадок.
8. После проявления соломенного окрашивания к раствору добавляем 1-2мл. раствора крахмала, раствор окрашивается в синий цвет. Титруем до бесцветной окраски.
Результаты титрования заносим в таблицу:
| Объем раствора CuSO4,мл | Сн, тиосульфата натрия, | Объем тиосульфата натрия, мл |
Рассчитываем нормальную концентрацию и массу меди в растворе.
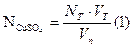
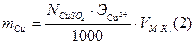
Контрольные вопросы
1. Суть йодометрического метода.
2. Какое вещество является окислителем и восстановителем, в окислительно-восстановительном процессе.
3. Напишите уравнение реакции процесса.
4. Какой применяется индикатор, его особенности.
5. Какой переход окраски необходимо предусмотреть.
6. Расчетная формула нормальности и массы меди в растворе.
7. Ход данной работы.
8. Техника безопасности, предусматриваемая в работе.
Лабораторная работа № 28
Приготовление раствора ЭДТА (комплексна III)
Определение нормальности и титра раствора комплексона III по сульфату магния
Цель: Изучить комплексонометрический метод титрования
Посуда и реактивы: Трилон Б, фиксанал сульфата магния или титрованный раствор, бюретка, пипетка, коническая колба, аммиачная буферная смесь, индикатор хром темно-синий, или эриохром черный
Задание: Выполните опыты, оформите отчет.
Правила техники безопасности:
1.Правила работы с реактивами.
2.Правила работы с химической посудой
Методические указания к выполнению лабораторной работы:
В основе метода находятся реакции образования комплексных соединений (металло-лигандные реакции).
Наибольшее значение из комплексонов имеет этилендиаминтетрауксусная кислота и ее двунатриевая соль (комплексон III или трилон Б – Na2H2T).
Формула Трилона Б
HOOCH3C H H CH3COONa
\ | | /
N – C = C – N
NaOOCH3 / | | \ CH3COOH
H H
Ход работы:
1.Производим расчет навески для приготовления 100мл 0,05н. раствора Трилона Б, (динатриевая соль этилендиаминтетрауксусной кислоты) необходимо взять:
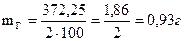
2.Установливаем титр раствора по 0,05 н. раствору сульфату магния, титрованному из фиксанала.
3.Отбираем пипеткой раствор в коническую колбу, добавляем половину объема аммиачного буфера, 80-90мл воды, щепотку индикатора, раствор окрасится в бурячный цвет.
Разраб.
Лит.
Листов
Пров.
Н. контр.
Утв.
4.Титрование производим до перехода окраски от бордовой в синею.
5.По среднему значению трех сходящихся результатов объемов титранта рассчитываем нормальность раствора Трилона Б.
Результаты заносим в таблицу:
Таблица
| Объем сульфата магния, мл | Сн, сульфата магния, | Объем Трилона Б, мл |
Рассчитываем нормальность и титр Трилона Б:
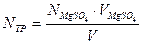
Контрольные вопросы
1. Суть комплексонометрического метода.
2. Индикатор, применяемый при установлении титра раствора Трилона Б.
3. Понятие о буферных растворах, их назначение и классификация.
4. Как готовиться титрованный раствор сульфата магния?
5. Расчет нормальности раствора.
6. Ход работы по приготовлению титрованного раствора Трилона Б и установлення его титра.
7. Техника безопасности, соблюдаемая при работе.
8. Какой необходимо предусмотреть переход окраски индикатора?
9. Формула Трилона Б и его реакционная формула.
Лабораторная работа № 29
Определение ионов металлов в растворах данным методом
Цель: Научиться определять содержание металлов в их солях комплексонометрическим методом прямого и обратного титрования с использованием различных индикаторов.
Посуда и реактивы: бюретка, пипетка, колба коническая, пробирка аналитическая, реактивы для получения качественных реакций, стакан для слива, ЭДТА титрованный, 25%-ный аммиак, мурексид, насыщенный раствор ацетата аммония, 2%-ный аммиак, аммиачный буферный раствор, эриохром черный Т,. контрольные растворы солей: меди, никеля, кобальта, магния, цинка
Задание: Выполните опыты, оформите отчет.
Правила техники безопасности:
1.Правила работы с реактивами.
2.Правила работы с химической посудой
Методические указания к выполнению лабораторной работы:
Метод комплексонометрии широко распространен для определения ионов Mg2+, Zn2+, Fe2+ и многих микроэлементов.
Ход работы:
1. Производим качественный анализ исследуемых растворов с целью обнаружения в растворе интересующих катионов.
2. Убедившись в присутствии катионов приступаем непосредственно к анализу.
Опыт 1 . Определение меди в солях меди:
1. Раствор в колбе с контрольной задачей доводим до метки водой.
2. Отбираем мерной пипеткой точный объем данного растворов коническую колбу.
3. По каплям добавляем разбавленный раствор аммиака до появления интенсивно синей окраски.
4. Затем полученный раствор сильно разбавляем дистиллированной водой, прибавляем индикаторный порошок мурексид. Раствор окрашивается в желтый цвет.
5. Титруем раствором ЭДТА до появления фиолетовой окраски.
Разраб.
Лит.
Листов
Пров.
Н. контр.
Утв.
Таблица
Опыт 2. Определение никеля в солях никеля:
1. В колбу с контрольным раствором доливаем до метки воды. Тщательно перемешиваем.
2. Отбираем пипеткой аликвотную часть раствора соли никеля.
3. Добавляем 50мл воды; 2мл 25%-ного раствора аммиака.
4. Добавляем столько мурексида, чтобы раствор окрасился в интенсивно желтый цвет.
Титруем до тех пор раствором ЭДТА, пока желтая окраска не прейдет в малиновую
Таблица
Опыт 3. Определение кобальта в солях кобальта
1. В колбу с контрольным раствором доливаем до метки воды.
2. Отбираем из мерной колбы аликвотную часть раствора соли кобальта.
3. Прибавляем в коническую колбу несколько капель насыщенного раствора ацетата аммония.
4. Прибавляем 100мл воды и мурексида до появления розовой окраски.
5. Добавляем по каплям 2% - ный раствор аммиака до появления фиолетовой окраски.
6. Титруем раствором ЭДТА до перехода окраски в малиновую.
Таблица
Опыт 4. Определение магния, цинка, кальция.
1. Доводим раствор в мерной колбе до метки.
2. Отбираем пипеткой 10мл раствора, прибавляем 50 мл H2O.
3. Прибавляем раствор 2мл аммиачного буфера, эриохрома черного Т.
4. Титруем раствором ЭДТА до перехода фиолетовой окраски в синею.
Таблица
ПРИМЕЧАНИЕ: Во всех случаях титрования, титрант ЭДТА находится в бюретке.
РАСЧЕТ: ведем по формулам прямого титрования.
Контрольные вопросы
1. Какие, Вы знаете, специфические качественные реакции на катионы: меди, никеля, кобальта, магния, цинка, кадмия, кальция?
2. Почему при исследовании необходимо подкислить или подщелочить раствор?
3. Как определяется медь в растворе?
4. Как определяется никель в растворе?
5. Как определяется кобальт в растворе?
6. Как определяется магний, цинк, кадмий, кальций в растворе?
7. Напишите уравнения реакций для каждого случая титровании.
8. Какие индикаторы, применяются в каждом случае и какой предполагается переход окраски индикаторов?
Лабораторная работа № 30
Определение жесткости воды комлексономерическим методом
Цель: пробрести навыки комплексонометрического титрования. Произвести анализ воды, по определению ее жесткости.
Посуда и реактивы: бюретка, пипетка, колба коническая, аммиачный буфер, Трилон Б, исследуемая вода, индикатор, хромоген черный.
Задание: Выполните опыты, оформите отчет.
Правила техники безопасности:
1.Правила работы с реактивами.
2.Правила работы с химической посудой
Методические указания к выполнению лабораторной работы:
Определение общей жесткости воды, обусловленное присутствием в ней ионов Са2+ и Mg2+, основано на реакции:
H2Y2- + Me2+(Ca2+,Mg2+) →1 MeY2- + 2H+
NаOOCH2C CH2COONa
\ /
N – CH2 – CH2 – N
/
|
|

 2020-10-11
2020-10-11 359
359





