Превращение горючих веществ при нагревании
Горючие вещества могут различаться по составу, агрегатному состоянию и другим свойствам. Однако воспламенение и самовоспламенение их происходят аналогично.
Твердые горючие вещества в зависимости от состава и строения ведут себя при нагревании по-разному. Например, сера, стеарин, каучук плавятся и испаряются. Такие вещества, как древесина, торф, каменный уголь, бумага при нагревании разлагаются с образованием газообразных продуктов и твердого остатка — угля. Некоторые горючие вещества при нагревании не плавятся и не разлагаются. К ним относятся кокс, антрацит, древесный уголь. Жидкие горючие вещества при нагревании испаряются.
Большинство горючих веществ независимо от их начального агрегатного состояния при нагревании переходит в газообразные продукты. С воздухом они образуют горючие смеси, подготовленные к горению.
Нагрев смеси горючего с воздухом приводит к тому, что при определенной температуре То начинается процесс окисления. Окисление горючих веществ сопровождается выделением тепла, которое при невысокой температуре и, следовательно, малой скорости реакции рассеивается в окружающую среду, поэтому самонагревания смеси не происходит. Только при более высокой температуре смеси и значительной скорости окисления не все выделяющееся тепло успевает отводиться в окружающую среду, и начинается самонагревание горючей смеси. В результате самонагревания смесь без внешнего источника тепла нагревается до температуры горения Тг,появляется пламя и возникает устойчивый процесс горения, который может продолжаться до полного выгорания вещества.
Процесс горения твердых веществ, при нагревании которых не образуется смесь горючих паров или газов с воздухом. В этом случае реакция окисления протекает на поверхности горючего материала, где и возникает горение.
Предложенная А. Н. Бахом и К. Энглером теория окисления была названа перекисной, так как согласно этой теории первыми продуктами окисления являются пероксиды и гидропероксиды. Органические пероксиды обычно рассматривают как производные пероксида водорода Н—О—О—Н, в котором один или два атома водорода замещены органическими радикалами Н—О—О—R. Если в пероксиде водорода один атом водорода замещен радикалом, такие оксидные соединения называются гидропероксидами К—О—О—Н.
Согласно перекисной теории окисления, активация кислорода происходит в результате разрыва одной связи между атомами в молекуле кислорода, на что требуется меньше энергии (343,6 кДж/моль), чем на полную
диссоциацию молекулы кислорода (488,3 кДж/моль).
О2 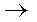 -О-О-
-О-О-
молекула активная молекула
кслорода кислорода
Активная молекула кислорода легко вступает в соединение с горючими веществами, не распадаясь на атомы
СН4 + -О-О- 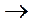 СН3— О—О—Н
СН3— О—О—Н
гидропероксид метила
СН3 – СН3 + -О-О- 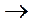 СН3 –О-О– СН3
СН3 –О-О– СН3
пероксид диметила
Энергия разрыва связи —О—О— в пероксидах и гидропероксидах значительно ниже (125—167 кДж/моль), чем в молекуле кислорода О2, поэтому они весьма реакционноспособны и обычно малоустойчивы. При нагревании и механических воздействиях они легко распадаются с образованием новых веществ или радикалов. Образующиеся при распаде пероксидов радикалы являются активными центрами реакций окисления.
Однако перекисная теория окисления не в состоянии объяснить существование индукционного периода, предшествующего видимой реакции, резкое действие следов примесей на скорость процесса и др. Это было объяснено учением о цепных реакциях.
Цепными называются реакции, идущие через ряд стадий (через ряд промежуточных реакций), в которых образуются промежуточные соединения со свободными валентностями, так называемые активные центры, являющиеся зародышами последующих быстропротекающих стадий процесса.
Цепные реакции могут быть разветвляющиеся и неразветвляющиеся. Типичной неразветвляющейся цепной реакцией является взаимодействие хлора с водородом. В ней каждый активный центр вызывает появление только одного нового активного центра; поэтому реакция может продолжаться, но не ускоряться. В разветвляющейся цепной реакции каждый активный центр зарождает два или более новых активных центра. Один из новых центров будет продолжать цепь, а второй начинает новую. Примером разветвляющейся цепной реакции может служить реакция водорода с кислородом, протекающая при низких давлениях и температуре около 900 °С.
Цепь Разветвление
I О2 + Н2 = 2 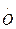 Н III
Н III 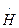 + О2 =
+ О2 =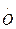 Н +
Н + 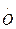
II 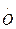 Н + Н2 = Н2О +
Н + Н2 = Н2О + 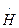 IV
IV 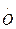 + Н2 =
+ Н2 =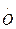 Н +
Н + 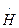
Обрыв цепи в объеме
V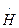 + О2 + М
+ О2 + М 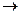 НО2 + М
НО2 + М
(М— молекула вещества, не участвовавшего в реакции).
Обрыв цепи на стенке
IV Н + Н + стенка 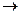 Н2
Н2
В результате реакций (III) и (IV) образуется по два активных центра; следовательно, при этих реакциях цепь разветвляется. Цепные реакции лежат в основе многих химических процессов, в том числе окисления и горения.
Основное отличие современного представления о механизме окисления от перекисной теории состоит в том, что начальной фазой процесса является не активация молекул кислорода, а активация молекул окисляющегося вещества.
Вещества с низкой начальной температурой окисления представляют наибольшую опасность, ибо они способны в процессе окисления самонагреваться, что иногда ведет к возникновению горения.
 2014-02-02
2014-02-02 3137
3137
