Метод
Метод
Элементарным анализом находят содержание основных элементов (C, H, N, S; W, A) в процентах, причём кислород определяют по разности вычитанием из 100% всех основных компонентов:
O = 100 – (C +H + N + S + W + A).
На практике обычно пользуются другим выражением:
C + H +О + N + S + W + A = 100%.
C + H + O + N – органическая масса топлива «О».
C + H + O + N + S – горючая масса топлива «Г».
C + H + O + N + S + A – сухая масса топлива «С».
C + H + O + N + S + A + W – рабочая масса топлива «Р».
Для пересчета состава топлива из одной массы в другую будем пользоваться таблицей 2.
Таблица 2
| Заданная масса | Масса топлива, в которую пересчитывают | |||
| органическая | горючая | сухая | рабочая | |
| Органическая | 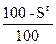
| 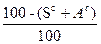
| 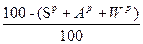
| |
| Горючая | 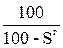
| 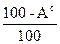
| 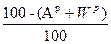
| |
| Сухая | 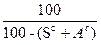
| 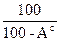
| 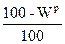
| |
| Рабочая | 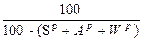
| 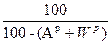
| 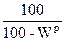
|
Задача.
Определить состав рабочего топлива по заданному его элементарному составу.
Дано: Со = 80%; Оо = 9%; Но = 8%; No = 3%; Sc = 1,5%; Ac = 10%; WP = 2%.
Найти: рабочую массу топлива (р.м.т.).
Решение:
Так как нужно определить состав рабочего топлива → определим содержание S и A в р.т.:
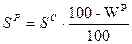 Þ
Þ 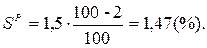
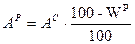 Þ
Þ 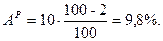
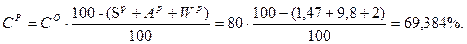
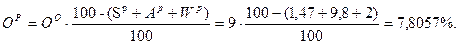
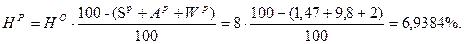
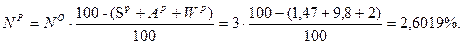
Проверка:
С + H + O + N + S + A + W =100%;
69,384 + 6,9384 + 7,8057 + 2,6019 + 1,47 + 9,8 + 2 = 100(%).
Ответ: рабочая масса топлива =100%.
Задача 2.
Дано: Сг = 89%; Ог = 2%; Нг = 4%; Nг = 2%; Sг = 3%; Ac = 10%; WP = 12%.
Найти: р.м.т.
Решение:
Так как нужно определить состав р.т. → определим содержание S и A в р.т:
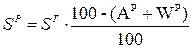 Þ
Þ 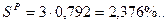
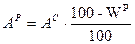 Þ
Þ 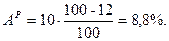
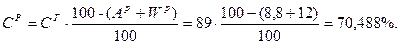
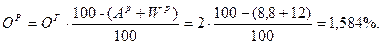
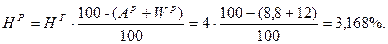
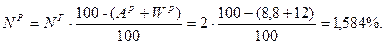
Проверка:
С + H + O + N + S + A + W =100%;
70,488 + 3,168 + 1,584 + 1,584 + 2,376 + 8,8 + 12 = 100%.
Ответ: рабочая масса топлива =100%.
Второй метод анализа предназначен для газообразного топлива.
Газообразное топливо состоит из смеси газообразных соединений: CO2; H2; CH4; C2H4; CmHn; H2S; CO; H2O; N2 и других.
Содержание перечисленных составляющих в объемных долях процента определяются специальным газовым анализом:
N2 = 100 – (CO2 + CO + H2 + CmHn + …).
Для пересчета рабочего топлива следует содержание влаги (г/см3) пересчитать на объем при нормальных условиях, приходящихся на 100 м3 сухого газа по формуле:
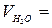 0, 1242 ∙W, (м3).
0, 1242 ∙W, (м3).
Если состав сухого газа:
COc2 + COc + Hc2 + CHc4 + CmHnc + Nc2 + Oc2 = 100%,
то состав влажного газа (р.м.т.) в объемных процентах определяется по формулам:
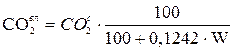 ;
;
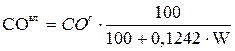 ;
;
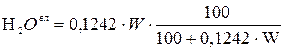 .
.
Задача 1.
Дано: 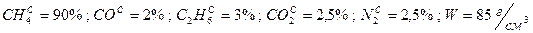 .
.
Найти: р.м.т.
Решение:
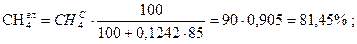
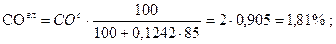
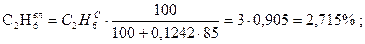
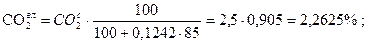
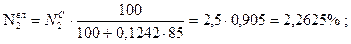
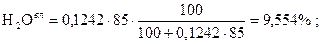
Проверка:
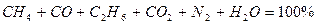 .
.
81,45 + 1,81 + 2,715 + 2,2625 + 2,2625 + 9,554 = 100,054» 100%.
Ответ: рабочая масса топлива 100%.
Задача 2.
Дано: 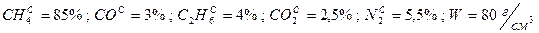 .
.
Найти: р.м.т.
Решение:
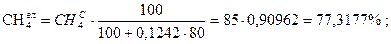
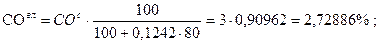
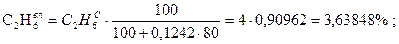
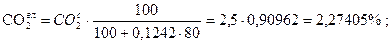
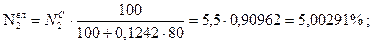
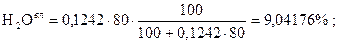
Проверка:
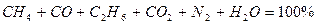
77,3177 + 2,72886 + 3,63848 + 2,27405 + 5,00291 + 9,04176 = 100,004» 100%.
Ответ: рабочая масса топлива 100%.
Теплота сгорания топлива – это количество тепла, выделяющееся при сжигании одной единицы топлива. [кДж/кг] – твердое, жидкое топливо; [кДж/м3] – газообразное топливо.
Различают высшую и низшую теплоты сгорания топлива:
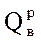 ,
, 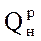 .
.
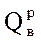 - пар конденсируется в жидкость с выделением теплоты парообразования.
- пар конденсируется в жидкость с выделением теплоты парообразования.
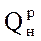 - влага остается в виде пара. Низшая теплота сгорания больше соответствует действительному положению, так как практически при сжигании топлива пары воды в газообразном состоянии уносятся с продуктами сгорания.
- влага остается в виде пара. Низшая теплота сгорания больше соответствует действительному положению, так как практически при сжигании топлива пары воды в газообразном состоянии уносятся с продуктами сгорания.
Для нагрева 1кг воды требуется 2516 кДж.
Разность между 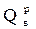 и
и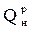 сгорания на 1кг рабочего топлива составляет:
сгорания на 1кг рабочего топлива составляет:
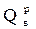 -
- 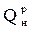 = 2516(
= 2516(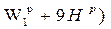 .
.
Если W1 и H выражены в процентах, то уравнение принимает вид:
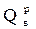 -
- 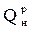 = 25,16(
= 25,16(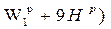
При расчете теплоты сгорания топлива наилучшие результаты дает формула Д.И.Менделеева, принятая для всех видов твердого и жидкого топлива:
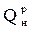 =
= 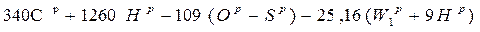
Теплоту сгорания газа можно определить по следующей формуле:
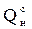 =
=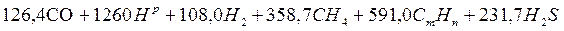
Для сравнения различных видов топлива введено понятие условного топлива.
Условное топливо – топливо, теплота сгорания которого 29,3МДж/кг (это теплота сгорания донецкого каменного угля).
Тепловой эквивалент топлива – это величина, полученная в результате деления низшей теплоты сгорания топлива на теплоту сгорания условного топлива.
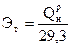
 2014-02-24
2014-02-24 1946
1946
