| Макросостояние (- орел; ¯- решка) | 10 0¯ | 9 1¯ | 8 2¯ | 7 3¯ | 6 4¯ | 5 5¯ | 4 6¯ | 3 7¯ | 8 2¯ | 9 1¯ | 10 0¯ |
| Микросостояние (число способов реализации w) |
Таким образом, на подносе в основном будет наблюдаться макросостояния, вероятность реализации которых максимальна.
Система, находящаяся в максимально упорядоченном состоянии (10-0), переходит в состояние менее упорядоченное (4-6), (5-5), (6-4). Величину w называют термодинамической вероятностью или статистическим весом. Статистический вес равен числу микросостояний, которыми реализуется данное макросостояние.
Если число монет на подносе n = 50, то 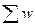 = 250 » 1015, а при n = 100 общее число микросостояний
= 250 » 1015, а при n = 100 общее число микросостояний 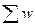 = 2100 » 1030, т.е. с увеличением числа объектов вероятность реализации упорядоченного состояния резко уменьшается. В одном моле вещества содержится число Авогадро частиц – N A = 6,02×1023. В системе при самопроизвольных процессах реализуется наиболее вероятное разупорядоченное состояние. Анализ этого модельного примера с монетами дает нам представление о молекулярно-кинетическом механизме направленности самопроизвольных процессов в изолированных системах к равновесному состоянию с максимумом энтропии: выравнивание температуры, давления, концентрации и т.п.
= 2100 » 1030, т.е. с увеличением числа объектов вероятность реализации упорядоченного состояния резко уменьшается. В одном моле вещества содержится число Авогадро частиц – N A = 6,02×1023. В системе при самопроизвольных процессах реализуется наиболее вероятное разупорядоченное состояние. Анализ этого модельного примера с монетами дает нам представление о молекулярно-кинетическом механизме направленности самопроизвольных процессов в изолированных системах к равновесному состоянию с максимумом энтропии: выравнивание температуры, давления, концентрации и т.п.
Проведя параллель между ростом термодинамической энтропии при приближении к равновесию и ростом при этом термодинамической вероятности, можно записать, что S ~ w (аналогичный подход осуществлялся при введении молекулярно-кинетической трактовки температуры). Для обоснования формулы Больцмана исходим из следующих предпосылок:
1) энтропия максимально упорядоченной системы примем равной нулю (к этому возвращаемся при рассмотрении третьего начала), с ростом энтропии упорядоченность снижается, т.е. энтропию можно рассматривать как меру неупорядоченности, меру хаоса в системе;
2) физическая величина является мерой какого-то свойства объекта или взаимодействия, если: а) обращается в нуль в отсутствии этого свойства или взаимодействия; б) изменяется в соответствии с этим свойством (взаимодействием). Например, сила является одной из мер взаимодействия тел, масса является мерой инертных свойств тела;
3) из примера с монетами следует, что при максимальной упорядоченности термодинамическая вероятность w = 1 (система реализуется единственным способом и в этом смысле хаос в системе отсутствует). Следовательно (предыдущий пункт), сама по себе термодинамическая вероятность w не может служить мерой энтропии, за меру энтропии принимаем логарифм термодинамической вероятности S ~ ln w. При полной упорядоченности (отсутствии хаоса) статистическая энтропия системы равна нулю (ln 1 = 0).
Больцман, а затем Планк, установили статистическую трактовку энтропии в форме S = k ln w,
где k = 1,38 ×10-23 Дж/К – постоянная Больцмана, введенная Планком.
Независимые эксперты. Из этого обсуждения следует, что хотя между термодинамической энтропией и энтропией Больцмана имеется корреляция, но эти представления не тождественны. Термодинамическая энтропия оперирует макроскопическими характеристиками системы, которые являются функциями координат и скоростей большого числа молекул. В состоянии термодинамического равновесия остаются постоянными не сами эти функции, а средние их значения за достаточно большой промежуток времени. Этими средними значениями оперирует термодинамическая энтропия. Энтропия же Больцмана оперирует понятием микросостояния. Макросостояние выражается усреднением микросостояний.
Преподаватель. Последний вопрос для обсуждения– третье начало термодинамики.
Эксперты в области статфизики. Согласно формуле Больцмана возрастание упорядоченности системы соответствует уменьшению статистического веса (в пределе w = 1) и, соответственно, уменьшению энтропии системы. Если принять, что при T = 0 K статистический вес термодинамической системы минимальный, то энтропия системы при T ® 0K стремится к своему минимальному значению: 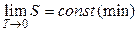 . Смысл теоремы Нернста заключается в утверждении, что при T = 0 K энтропия системы имеет минимальное фиксированное значение и вблизи абсолютного нуля процессы происходят без изменения энтропии. Это утверждение и составляет содержание теоремы Нернста. Значение при T = 0 K удобно принять равным нулю (w = 1):
. Смысл теоремы Нернста заключается в утверждении, что при T = 0 K энтропия системы имеет минимальное фиксированное значение и вблизи абсолютного нуля процессы происходят без изменения энтропии. Это утверждение и составляет содержание теоремы Нернста. Значение при T = 0 K удобно принять равным нулю (w = 1): 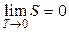 .
.
Эксперты в области термодинамики. Из понятия термодинамической энтропии (точнее, приращения энтропии) 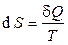 следует, что при понижении температуры системы (охлаждения системы) ее энтропия уменьшается. Третье начало постулирует, что уменьшение энтропии при приближении к нулевой абсолютной температуре имеет предел, который стремится к определенному конечному пределу. Этот предел считается равным нулю:
следует, что при понижении температуры системы (охлаждения системы) ее энтропия уменьшается. Третье начало постулирует, что уменьшение энтропии при приближении к нулевой абсолютной температуре имеет предел, который стремится к определенному конечному пределу. Этот предел считается равным нулю: 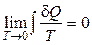 . При T = 0 K энтропия системы не зависит от всевозможных характеристик вещества (агрегатного состояния, давления, химического состава и т. д.) и принимается равной нулю S 0 = 0. Данный постулат имеет опосредованное экспериментальное основание: теплоемкость твердых тел не является постоянной величиной и становится исчезающее малой при приближении к Т = 0 К. Теорема Нернста фактически постулирует, что при абсолютном нуле температуры все процессы происходили бы без изменения энтропии. Из теоремы Нернста получаем важное следствие: температура 0 К не может быть достигнута конечным числом процессов в термодинамической системе.
. При T = 0 K энтропия системы не зависит от всевозможных характеристик вещества (агрегатного состояния, давления, химического состава и т. д.) и принимается равной нулю S 0 = 0. Данный постулат имеет опосредованное экспериментальное основание: теплоемкость твердых тел не является постоянной величиной и становится исчезающее малой при приближении к Т = 0 К. Теорема Нернста фактически постулирует, что при абсолютном нуле температуры все процессы происходили бы без изменения энтропии. Из теоремы Нернста получаем важное следствие: температура 0 К не может быть достигнута конечным числом процессов в термодинамической системе.
Преподаватель. Обратим внимание на обобщающую схему, на которой пока не указаны логические связи между структурными элементами термодинамики и укажем эти связи. Методология учебного познания по термодинамике соответствует гносеологической цепочке познания - от единичного к общему, а от него - к предельно общему. Термодинамика как фундаментальная физическая теория содержит эмпирическое основание, теоретическое ядро и дедуктивные следствия. Начала термодинамики вместе с теоретической моделью тел образуют теоретическое ядро термодинамики и образующими постулативную базу этой физической теории. Нулевое, первое и второе начала вводят в структуру термодинамики функции состояния: температуру T, внутреннюю энергию U, энтропию S. Третье начало не вводит в термодинамику какую-то новую функцию состояния, однако это начало реализует численную определенность других функций состояния (термодинамических потенциалов), которые вводятся в термодинамику для описания конкретных термодинамических систем. Экспериментальная проверка выводных (дедуктивных) законов, описывающих свойства конкретных термодинамических систем, опосредованно подтверждают верность начал термодинамики.
 2014-02-24
2014-02-24 2574
2574






