Основные положения квантовой механики.
В 1900 г Макс Планк предположил, что поглощение либо испускание энергии может осуществляться строго определенными дискретными порциями – квантами:
Е = hν,
где h – постоянная Планка (равная 6,62 10-34 Дж с), ν – частота излучения, (равная ν = с/λ, где с – скорость света, λ – длина волны).
Бор предложил, что момент количества движения электрона (р) кратен h/2π:
p = h/(2π).
1905 г Эйнштейн постулировал, что любое излучение состоит из дискретных частиц-квантов излучения, называемых фотонами (ΔЕ = mc2). В результате возникло представление о двойственной природе света (дифракция, интерференция и свойства корпускул).
В 1924 г Луи де Бройль распространил это представление на электроны. Объединив уравнения ΔЕ=mc2 и Е=h.ν, получил уравнение для определения длины волны, которое носит его имя – волна де Бройля: λ = h/mc.
Таким образом, электрон обладает и свойствами частицы и волны одновременно, т.е. корпускулярно-волновой дуализм.
В 1927 г Гейзенберг формулирует принцип неопределенности: положение и скорость электронов не поддаются одновременному определению с абсолютной точностью:
Dх∙D(m∙υ) ≥ h/2π,
где m – масса электрона, Dυ и Dх – ошибка в определении скорости и координаты электрона соответственно.
В каждый момент времени точно можно определить лишь одно из этих двух свойств. Поэтому принято представление об электронном облаке.
Область пространства, в которой высока вероятность обнаружения электрона, называется орбиталью. Орбиталь может рассматриваться как некоторое распределение заряда в пространстве – электронное облако.
Энергетический уровень электрона в атоме определяется четырьмя квантовыми числами.
1. Главное квантовое число n (n = от 1 до ¥) определяет энергию электрона (ē) на уровне в атоме, Е = –A/ n 2 и радиус наибольшей вероятности его нахождения r = n 2/B (где А и В – постоянные для данного атома химического элемента, зависимые только от заряда ядра).
2. Орбитальное квантовое число (l = 0, 1, 2,…до (n–1)) определяет форму электронного облака и энергию электрона на подуровне:
| под уровень | s | p | d | f |
| l |
3. Магнитное квантовое число (m = – l, 0, + l) определяет расположение орбитали в пространстве.
Число возможных энергетических орбиталей на подуровне равно (2 l +1). Графически атомная орбиталь изображается .
| Орбитальное квантовое число (l) | Магнитное квантовое число (m) | Число атомных орбиталей | |
| s | | ||
| p | –1,0,+1 | | |
| d | –2, –1, 0, +1, +2 | | |
| f | –3, –2, –1, 0, +1, +2, +3 | . |
4. Спиновое квантовое число (ms), 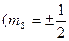 ). Упрощенно спин можно представить как характеристику собственного вращения электрона вокруг своей оси.
). Упрощенно спин можно представить как характеристику собственного вращения электрона вокруг своей оси.
 2014-02-24
2014-02-24 2357
2357
