Формирование состава подземных вод.
12.1. Условия формирования химического состава подземных вод
В верхней части земной коры подземная вода, движущаяся в различных толщах горных пород и, взаимодействуя с ними, растворяет и выщелачивает содержащиеся в них вещества и, таким образом, превращается в раствор сложного состава. Инфильтрующаяся в горные породы атмосферная, слабо минерализованная вода, обогащается по пути движения не только различными солями, но и органическим веществом и газами. Изменение химического состава подземных вод происходит в результате смешения вод различной минерализации, испарения и т.д. К числу основных природных условий, от которых зависит химический состав подземных вод, относятся: климатические особенности, характер почвенного слоя, состав горных пород, деятельность живых организмов.
В районах избыточного увлажнения вследствие интенсивного питания и подземного стока подземные воды слабо минерализованы. В засушливых степях наоборот.
Процесс формирования химического состава подземных вод весьма сложен. Г.Н.Каменским выделены следующие основные генетические циклы:
|
|
|
1. Инфильтрационный или континентальный, связанный с процессами выветривания в верхних слоях земной коры;
2. Морской или осадочный, связанный с проникновением морских вод в толщи пород в процессе осадкообразования;
3. Метаморфический и магматический.
12.2. Макрокомпоненты химического состава подземных вод
К этому понятию относят элементы, составляющие основную часть минерализации. Они определяют геохимический облик воды. В гидрохимии используют шестикомпонентный состав подземных вод:
анионы: 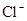 ,
, 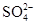 , (
, (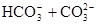 )
)
катионы: 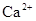 ,
, 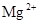 , (
, (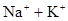 ).
).
Распределение макрокомпонентов с ростом минерализации следующее: в области пресных вод преобладает гидрокарбонат-ион, сульфат-ион в солоноватых и хлор-ион в соленых водах. В катионном составе пресные воды обычно кальциевые, а соленые – натриевые. Эти закономерности объясняются растворимостью соединений 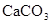 и
и 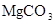 ,
, 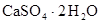 и NаСl, которые при росте минерализации ограничивают накопление соответствующих ионов.
и NаСl, которые при росте минерализации ограничивают накопление соответствующих ионов.
Хлор-ион – наиболее часто содержится в подземных водах в виде соединения NaCl. Накапливаясь в океане, хлор является затем основным компонентом седиментационных вод. Для пресных подземных вод источником хлора могут быть хлорсодержащие минералы. Техногенный фактор также ведет к увеличению содержания хлора в подземных водах.
Как правило, подземные воды, предназначенные для питьевого использования, не должны содержать более 350 мг/л хлор-иона.
Сульфат-ион. Происхождение иона 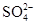 различно. Он может образовываться в результате выщелачивания из горных пород (гипс, ангидрит), а также в процессе окисления сернистых соединений (пирит). В питьевых водах содержание
различно. Он может образовываться в результате выщелачивания из горных пород (гипс, ангидрит), а также в процессе окисления сернистых соединений (пирит). В питьевых водах содержание 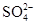 обычно не должно превышать 500 мг/л.
обычно не должно превышать 500 мг/л.
|
|
|
Гидрокарбонат- и карбонат-ион. В гидросфере их содержание гораздо ниже содержания хлора и сульфата. Причина заключается в образовании трудно растворимых карбонатов кальция и магния. Гидрокарбонатные ионы преобладают в природных водах при минерализации до 0.5 г/л. В солоноватых и соленых водах их мало.
Натрий-ион широко распространен, входит в состав многих силикатов и легкорастворимых минералов. В природных водах хорошо коррелируется с содержанием хлора. Находится в пресных соленых водах. Источником натрия являются легкорастворимые соли, морская вода и т.д. В питьевой воде не должно содержаться натрия более 200 мг/л.
Калий-ион хорошо сорбируется глинистыми минералами. Первичные калиевые минералы разрушаются медленнее, чем натриевые. В природе калий быстрее, чем натрий образует трудно растворимые соединения. Высокие содержания калия в подземных водах могут указывать на месторождения калийных солей.
Кальций-ион. В пресных водах ион кальция хорошо коррелируется с гидрокарбонат-ионом, в солоноватых – с сульфат-ионом. Основным источником кальция в подземных водах служат карбонатные породы, гипс, плагиоклазы. Кальций совместно с магнием образует важную характеристику воды – ее жесткость. Для питьевых целей используется вода с общей жесткостью до 7 мг-экв/л.
Магний-ион. Растворимость его минералов выше, чем кальциевых. Однако, в природных водах он играет подчиненную роль, его концентрация мало зависит от минерализации. Основные источники магния в пресных водах – доломит и доломитизированные известняки.
Железо в подземных водах обычно находится в закисной (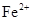 ) или в окисной (
) или в окисной (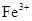 ) форме. Закисные соединения неустойчивы и при доступе кислорода легко окисляются. При выпадении гидратов Fe в осадок, происходит помутнение воды (желтовато-бурая окраска). В питьевых водах допускается содержание железа до 1 мг/л.
) форме. Закисные соединения неустойчивы и при доступе кислорода легко окисляются. При выпадении гидратов Fe в осадок, происходит помутнение воды (желтовато-бурая окраска). В питьевых водах допускается содержание железа до 1 мг/л.
Соединения азота. В природных водах встречаются неорганические (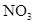 ,
, 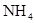 ,
, 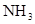 ) и органические соединения азота. Особенно высоких концентраций может достигать содержание нитратов в природных водах сельскохозяйственных районов, где используются азотные удобрения. При разложении живого вещества органический азот переходит в аммонийную форму, которая, окисляясь, переходит в нитратную.
) и органические соединения азота. Особенно высоких концентраций может достигать содержание нитратов в природных водах сельскохозяйственных районов, где используются азотные удобрения. При разложении живого вещества органический азот переходит в аммонийную форму, которая, окисляясь, переходит в нитратную.
Соединения азота в воде – индикатор загрязнения: 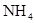 и
и 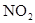 на свежее, а
на свежее, а 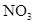 – на старое загрязнение. В питьевой воде содержание
– на старое загрязнение. В питьевой воде содержание 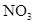 не должно превышать 10 мг/л.
не должно превышать 10 мг/л.
Фтор – наименьшее его содержание отмечается в пресных водах с большим количеством гуминовых веществ. Резко повышены содержания фтора в термальных водах. Основным источником фтора в воде являются атмосферные осадки и фторсодержащие минералы (флюорит и др.). В питьевой воде фтора не должно быть больше 0.7-1.5 мг/л.
Бром – рассеянный элемент. Соединения брома хорошо растворимы, миграция его высока. Бром накапливается преимущественно в морской воде и рапах озер. В пресных подземных водах его содержание 5-20 мг/л. Единственный процесс выведения брома из подземных вод – это сорбция глинистыми минералами и органическими соединениями. Широко используются бромные минеральные воды. Для решения гносеологических вопросов используется Cl/Br соотношение (коэффициент).
Бор. В природных водах концентрация бора изменяется широко. Повсеместно содержание бора в щелочных подземных водах – до сотен мг/л. Основным источником бора в подземных водах являются его минералы: бораты, турмалин и др.
Стронций – его поведение в природных водах похоже на поведение кальция. В питьевой воде содержание стронция не должно превышать 2 мг/л. Более высокие содержания могут приводить к заболеваниям костной ткани.
|
|
|
Микрокомпоненты. К ним относятся все другие элементы. В подземных водах обнаружено около 40 микрокомпонентов. Фоновые содержания микрокомпонентов в пресных подземных водах составляют микрограммы на литр. Разнообразны формы миграции. Большинство их мигрирует в истинно растворенной форме.
12.3. Газовый состав подземных вод
Все подземные воды содержат растворенные газы. Кислород (О2) попадает в воды из воздуха и в результате химической активности быстро связывается. Часто встречается в зоне активного обмена вод. В глубинных пластах он обычно отсутствует.
Азот (N2) в подземных водах является обязательным элементом. Содержание его в водах большинства нефтегазоносных бассейнов колеблется от 10 до 400 см3/л. Основным источником азота в пластовых водах является органическое вещество. Другим источником газообразного азота является выделяющийся в процессе метаморфизма осадочных пород связанный азот.
Углекислый газ (СО2). Источником углекислоты в осадочных породах является органическое вещество. Углекислота вступает в реакции в осадочных породах с образованием карбонатов и бикарбонатов. Большое количество углекислоты поступает в пластовые воды в результате метаморфизма карбонатных и магматических пород.
Сероводород (Н2S) широко развит в районах минерализованных вод. В зоне гипергенеза Н2S образуется при взаимодействии сульфатов с органическим веществом, при участии сульфат-восстанавливающих бактерий.
Водород (Н+), гелий (Не), аргон (Аr) из воздуха поступает в небольших количествах. Основным источником этих газов являются радиоактивные процессы.
 2014-02-13
2014-02-13 3959
3959