
Аналогично протекает эта реакция и с нерастворимыми основаниями:
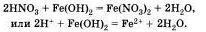
Вторая реакция протекает между оксидами металлов и большинством кислот, например:
CuO+ H2SO4 = CuSO4+ H2O
Чтобы прошли третья реакция, необходимо выполнить несколько условий.
1) Ознакомимся с рядом напряжений металлов (точнее, рядом стандартных электронных потенциалов):
К, Са, Na, Мn, Аl, Zn, Fе, Ni, Sn, РЬ, Н2, Сu, Нg, Аg, Аu. Металл должен находиться в этом ряду до водорода.
А вот реакция между раствором соляной кислоты и медью невозможна, так как медь стоит в ряду напряжений после водорода.
2) Должна получиться растворимая соль. Во многих случаях взаимодействие металла с кислотой практически не происходит потому, что образующаяся соль нерастворима и покрывает поверхность металла зашитной пленкой, например:
Рb + H2SO4 =/ PbSO4 + H2
Нерастворимый сульфат свинца (II) прекращает доступ кислоты к металлу, и реакция прекращается, едва успев начаться. По данной причине большинство тяжелых металлов практически не взаимодействует с фосфорной, угольной и сероводородной кислотами.
3) Третья реакция характерна для растворов кислот, поэтому-нерастворимые кислоты, например кремниевая, не вступают в реакции с металлами.
4) Концентрированный раствор серной кислоты и раствор азотной кислоты любой концентрации взаимодействуют с металлами несколько иначе, поэтому уравнения реакций между металлами и этими кислотами записываются подругой схеме. Разбавленный раствор серной кислоты взаимодействует с металлами. стоящими в ряду напряжении до водорода, образуя соль и водород.
Четвертая реакция является типичной реакцией ионного обмена п протекает только в том случае, если образуется осадок или газ, например:
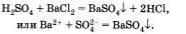
Приведем пример реакции кислоты с солью, протекающей с выделением газа:
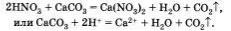
 2015-01-30
2015-01-30 4645
4645
