Атомы имеют сложное строение: в центре атома находится ядро, а на некотором расстоянии от ядра движутся электроны.
Ядро атома состоит из частиц двух видов - протонов и нейтронов. Нейтроны являются незаряженными частицами, а протоны имеют положительный заряд, по абсолютной величине равный заряду электрона (+ 1,6 × 10-19 Кл). Такой заряд в атомной физике принимается равным единице. Поэтому говорят, что протон имеет заряд +1, а электрон -1. Протоны и нейтроны имеют почти одинаковую массу, которая в 1840 раз больше массы электрона. Следовательно, масса атома практически полностью определяется массой его ядра.
В ходе химических взаимодействий ядра атомов не изменяются. Поэтому ядро может рассматриваться как материальная точка, имеющая массу и заряд.
Химический элемент - вид (сорт) атомов, характеризующийся строго определенным зарядом ядра. Например, все атомы, ядро которых имеет заряд +6, называются химическим элементом “углерод”.
Химические свойства атомов определяются их электронным строением. Поведение электрона в атоме описывается специальной наукой, которая называется квантовая механика. В основу квантовой механики положена гипотеза Луи де Бройля о волново-корпускулярном дуализме микрочастиц (электронов, протонов, нейтронов и т.п.). Исходя из этой теории электрону присущи как свойства вещества (масса, заряд), так и свойства волны. Следствием волнового поведения электрона в атоме является то, что его местонахождение в пространстве нельзя точно определить. Можно говорить лишь о вероятности нахождения этой частицы в некотором объеме. Поведение электрона в атоме как волны описывается уравнением, предложенным Шредингером в 1925 г. Это сложное математическое выражение, решением которого являются орбитали.
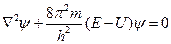
где: Ñ2- дифференциальный оператор, представляющий собой сумму вторых частных производных по соответствующим координатам, m0 - масса покоя электрона, E - полная энергия электрона, U - потенциальная энергия электрона.
Атомная орбиталь - это состояние электрона в атоме. Состоянием электрона называется его энергия и область пространства, в которой электрон находится с вероятностью 90 %.
Решение уравнения Шредингера удобно получать в виде квантовых чисел, которые могут иметь следующие значения:
1. Главное квантовое число (n)
n = 1, 2, 3, 4,..... ¥.
2. Побочное (орбитальное) квантовое число (l)
l = 0, 1, 2, 3,...... (n - 1).
Для значений орбитального квантового числа часто используются буквы:
l = 0, 1, 2, 3, 4, 5......
s, p, d, f, q, h......
3. Магнитное квантовое число (m)
m = 0, ±1, ±2, ±3,...... ± l или
m = - l... -3, -2, -1, 0, +1, +2, +3... + l.
Каждый разрешенный набор из этих трех квантовых чисел описывает одну орбиталь.
Для описания электрона в атоме существует еще одно квантовое число - спиновое квантовое число (s), которое может принимать два значения:
s = -1/2; +1/2.
Cпин - это особое свойство материи (подобное массе или заряду). Что такое спин объяснить невозможно (попробуйте объяснить, что такое «электрический заряд»).
Все электроны подчиняются принципу Паули: 2 электрона в данном атоме не могут иметь абсолютно одинаковый набор из четырех квантовых чисел (n, l, m, s). Следствием принципа Паули является то, что состояние электрона в атоме однозначно описывается строго определенным набором из четырех квантовых чисел. По принципу Паули на одной орбитали могут одновременно находиться не более двух электронов, причем с разными спинами (-1/2, +1/2).
На энергетических диаграммах орбиталь обычно изображается в виде квадратика, а электрон на орбитали в виде стрелки. Стрелка, направленная вверх (), означает s = +1/2. Стрелка, направленная вниз (¯), означает s = -1/2.
Орбитали с одинаковыми значениями n и l составляют подуровень. Число орбиталей, входящих в подуровень, равно количеству возможных значений магнитного квантового числа (m).
Например, подуровень 3 р (n = 3, l = 1) cостоит из 3-х орбиталей:
n=3 n=3 n=3
l=1 l=1 l=1
m=-1 m=0 m=+1
Нетрудно доказать, что любой s - подуровень (l = 0) состоит из одной орбитали; любой p - подуровень (l = 1) - из трех; d - подуровень (l = 2) - из пяти; f - подуровень (l = 3) - из 7 орбиталей.
Все подуровни с одинаковым значением главного квантового числа (n) объединяются в уровень (слой). Число подуровней, составляющих данный уровень равно количеству возможных значений l:
первый уровень (n = 1) состоит из подуровня 1 s (l = 0);
второй уровень (n = 2) включает подуровни 2 s (l = 0) и 2 p (l = 1); третий уровень (n = 3) включает подуровни 3 s (l = 0), 3 p (l = 1) и 3 d (l = 2).
Квантовые числа определяют следующие параметры орбиталей:
1) Форма орбитали определяется орбитальным квантовым числом (l):
l = 0 s - форма (шарообразная)
l = 1 p - форма (гантелеобразная)
l = 2 d - форма
l = 3 f - форма
2) Ориентация орбитали в пространстве задается магнитным квантовым числом (m). Например, любые р - орбитали данного уровня вытянуты по осям координат x, y, z.
3) Энергия орбитали определяется квантовыми числами n и l по правилам Клечковского:
I правило Клечковского: чем меньше сумма (n + l), тем ниже по энергии данная орбиталь.
II правило Клечковского: если у нескольких орбиталей сумма (n+l) одинакова, то меньшую энергию имеет та, у которой меньшее значение n.
Следствием из правил Клечковского является то, что орбитали, входящие в данный подуровень, имеют абсолютно одинаковую энергию. Это нетрудно доказать. Рассмотрим орбитали 2 р - подуровня. У этих трех орбиталей одинаковые значения n и l (n = 2, l = 1). Как первое, так и второе правила Клечковского дают равенство по энергии 2 рx, 2py, 2pz - орбиталей. Поэтому имеет смысл сравнивать по энергии не отдельные электронные орбитали, а целые подуровни.
Применение правил Клечковского дает следующую последовательность заполнения подуровней электронами:
1 s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d.... Зная эту последовательность можно написать электронную формулу атома любого элемента Периодической системы или его иона. Для этого необходимо заполнить приведенную выше последовательность слева направо с учетом того, что максимальная емкость любого s - подуровня равна 2 электронам, любого р - подуровня - 6 электронам, любого d - подуровня - 10 электронам, любого f - подуровня - 14 электронам.
Примеры: 1) Написать электронную формулу атома серы.
Сера имеет порядковый номер в Периодической системе равный 16. Значит, атом серы имеет 16 электронов.
Электронная формула атома S: 1s2 2s2 2p6 3s2 3p4.
2) Написать электронную формулу иона Mn+2.
Марганец имеет № 25. В атоме марганца 25 электронов. Ион имеет на 2 электрона меньше, чем атом: 1s2 2s2 2p6 3s2 3p6 4s2 3d3.
Более точным способом описания электронного строения атома (или иона) является энергетическая диаграмма. На энергетической диаграмме каждая орбиталь изображается квадратом, электроны - стрелками:
 - орбиталь, - электрон (s =+
- орбиталь, - электрон (s =+ 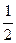 ), ¯ - электрон (s = -
), ¯ - электрон (s = - 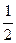 ).
).
Заполнение орбиталей электронами происходит в соответствии с 3-мя законами (правилами):
1. Принцип наименьшей энергии (два правила Клечковского).
2. Принцип Паули.
3. Правило Хунда: в пределах одного подуровня электроны распределяются таким образом, чтобы их суммарный спин по модулю был максимален.
Пример: Энергетическая диаграмма атома железа.
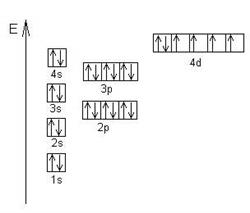
По электронному строению все элементы Периодической системы делятся на 4 типа: s - элементы, p - элементы, d - элементы и f - элементы. Если последний электрон в атоме (имеющий наибольшую энергию) является s - электроном, то данный элемент называется s - элементом. Например, все щелочные металлы являются s - элементами. Аналогично определяются p-, d-, f - элементы.
Отметим, что из 105 элементов Периодической системы 20 имеют отклонения от правил Клечковского в заполнении подуровней. Отклонения относительно небольшие (1 - 2 электрона) и встречаются только у d и f - элементов.
Пример. Хром должен был иметь электронную формулу:
1s2 2s2 2p6 3s2 3p6 4s2 3d4. Реально хром имеет: 1s2 2s2 2p6 3s2 3p6 4s1 3d5.
Все элементы Периодической системы делятся на металлы и неметаллы. Металлы - это элементы, которые никогда не проявляют отрицательных степеней окисления. Более 80 химических элементов являются металлами. Неметаллы хотя бы в одном своем соединении имеют отрицательную степень окисления. Такое деление является несколько формализованным, так как понятие степени окисления само по себе условно (см. тему «ОВР»).
Деление элементов на металлы и неметаллы можно осуществить, исходя из значений их электроотрицательности (ЭО). Наиболее просто электроотрицательность рассчитывается по уравнению:
ЭО = 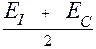 ,
,
где ЕI - энергия ионизации атома (энергия, которую необходимо затратить для отрыва электрона от атома); EC - энергия сродства к электрону (энергия, которая выделяется при присоединении к атому электрона).
Как правило, пользуются не абсолютными значениями ЭО, рассчитанными по приведенному выше уравнению, а относительными ЭО (ОЭО). За единицу измерения принято считать ЭО атома лития. Тогда ОЭО элемента Х можно найти как:
ОЭО(Х) = ЭО(Х) / ЭО(Li).
Значения ОЭО для большинства элементов приведены в таблице 1. Из таблицы 1 видно, что ОЭО металлов лежат в промежутке 0,7 - 2,3, а неметаллов 1,7 - 4,0. Следовательно, границу между металлами и неметаллами можно провести приблизительно) при значении ОЭО = 2 ± 0,3.
Одним из важнейших научных обобщений в химии является Периодический закон Д.И.Менделеева. Современная формулировка его выглядит следующим образом: свойства элементов, а также их соединений находятся в периодической зависимости от зарядов их ядер. Иначе, при монотонном увеличении заряда ядра свойства элементов примерно повторяются через определенный промежуток (период).
Например, при увеличении заряда ядра от +3 (Li) до +10 (Ne), свойства элементов резко изменяются от типично металлических (Li, Be) до свойств сильных неметаллов (N, O, F). Но затем у элемента № 11 (Na) происходит возврат к свойствам сильного металла. Кроме того, многие химические свойства лития и натрия довольно схожи.
Свойства элемента определяются электронным строением их атомов. Все входящие в атом электроны можно разделить на валентные и невалентные. Валентными являются электроны внешних s- и p- подуровней, а также незавершенных (частично заполненных) d- и f- подуровней. Именно валентные электроны определяют химическое поведение данного элемента. Все остальные электроны в атоме являются невалентными. Они не принимают участия в химических взаимодействиях.
Сравним электронное строение лития и натрия. Электронные формулы этих элементов:
Li 1s2 2s1
Na 1s2 2s2 2p6 3s1.
Валентные электроны Li и Na подчеркнуты. Все невалентные электроны представляют собой законченную электронную конфигурацию благородного газа:
Li [He] 2s1
Na [Ne] 3s1.
С литием и натрием химически сходны калий, рубидий, цезий и франций. Все они имеют аналогичное электронное строение:
K [Ar] 4s1
Rb [Kr] 5s1
Cs [Xe] 6s1
Fr [Rn] 7s1.
Ввиду высокой схожести шесть элементов, рассмотренных выше, объединены в одно семейство (щелочные металлы). Для них можно написать обобщенную электронную формулу:
[Б.Г.] ns1,
где [Б.Г.] означает законченную электронную оболочку ближайшего к данному элементу благородного газа; n - номер периода, в котором находится данный элемент.
Рассмотренный пример показывает, что физической причиной периодичности свойств элементов является периодическое повторение сходных электронных структур при монотонном увеличении заряда атомного ядра.
Графическим отображением Периодического закона является Периодическая система элементов (ПСЭ). ПСЭ имеет четкую внутреннюю организацию. В ней выделяются периоды, группы и подгруппы.
Период - это ряд элементов с последовательно увеличивающимися номерами (зарядами ядер), внутри которого свойства изменяются от свойств щелочного металла до свойств благородного газа.
Подгруппа включает элементы, имеющие одинаковое строение валентных уровней. Элементы одной подгруппы, как правило, очень похожи по химическим свойствам. Подгруппы делятся на главные и побочные. Главные подгруппы включают только s или p - элементы. Побочные подгруппы содержат только d и f - элементы.
Группа объединяет элементы одной главной и одной побочной подгрупп. Например, VI группа ПСЭ включает главную подгруппу (VIA): O, S, Se, Te, Po и побочную подгруппу (VIB): Cr, Mo, W. Элементы главной и побочной подгрупп одной группы могут быть похожи по химическим свойствам только в тех соединениях, где они имеют валентность, равную номеру группы. Во всех остальных соединениях элементы разных подгрупп очень непохожи.
Для ПСЭ известны следующие тенденции в изменении свойств элементов иих соединений при движении по периоду (слева направо) и главной подгруппе (сверху вниз):
1. В пределах периода металлические свойства ослабевают, а неметаллические усиливаются. В главной подгруппе металлические свойства усиливаются, а неметаллические ослабевают.
2. В периоде свойства высших оксидов меняются от типично основных до типично кислотных (высшим соединением элемента называется такое, в котором он проявляет валентность, равную номеру группы). В периоде свойства высших гидроксидов меняются от основных до кислотных. Гидроксидом называется неорганическое соединение, состоящее из атомов трех элементов: водорода, кислорода и любого третьего элемента (например: KOH; Al(OH)3; H2SO4).
3. В главной подгруппе основные свойства оксидов усиливаются, а кислотные ослабевают. В главной подгруппе основные свойства гидроксидов усиливаются, а кислотные ослабевают.
4. Характер оксидов и гидроксидов одного элемента зависит от его степени окисления. Чем она выше, тем сильнее в данном соединении выражены кислотные свойства. Чем ниже степень окисления, тем более вероятно наличие основных свойств.
5. В главной подгруппе сила бескислородных кислот увеличивается. Например, в ряду HF, HCl, HBr, HJ самой слабой кислотой является HF, а самойсильной HJ.
6. В главной подгруппе сила кислородсодержащих кислот уменьшается. Например, в ряду H2SO4, H2SeO4, H2TeO4, H2PoO4 самой сильной является серная кислота, а самой слабой - полониевая.
7. В периоде энергия ионизации и энергия сродства к электрону увеличиваются. Поэтому увеличивается и ОЭО. В главной подгруппе энергия ионизации, энергия сродства к электрону и ОЭО уменьшаются.
Темы 2-3. Химическая связь. Строение вещества в конденсированном состоянии
Основным объектом изучения химии являются химические процессы (химические реакции). В ходе любой химической реакции происходит изменение химических связей между атомами (старые связи исчезают, новые - появляются). Поэтому понятие химической связи является, пожалуй, наиболее важным понятием химии.
Химическая связь - это взаимодействие атомов по законам квантовой механики, при котором:
1. Происходит перекрывание валентных орбиталей атомов.
2. Происходит обобществление валентных электронов взаимодействующих атомов.
3. Понижается общая энергия системы (под системой понимается: молекула, сложный ион, радикал, кристалл).
Деление химической связи на типы появилось до объяснения ее с позиций квантовой механики. Деление это условно. Различают 3 основных типа химических связей (ионная, ковалентная, металлическая) и 1 дополнительный тип (водородная). Следует учитывать, что в ряде веществ химическая связь не может быть отнесена к определенному типу. Например, в кристалле FeO связь ионно-ковалентная, в чистом железе - связь ковалентно-металлическая, а в соединении Fe3C - ионно-ковалентно-металлическая. Тем не менее, в первом приближении можно условно считать, что в FeO и Fe3C связь в основном ионная, а в Fe - металлическая.
Представления о типах химических связей появились в начале ХХ века, когда среди химиков было модно мнение о том, что атомы в ходе взаимодействия “стремятся” приобрести законченную электронную оболочку инертного (благородного) газа: He, Ne, Ar, Kr, Xe, Rn.
Ионная связь. Рассмотрим взаимодействие между двумя атомами, один из которых является типичным металлом (например, натрий), а другой - сильным неметаллом (например, хлор). Валентные электроны атомов изобразим точками:
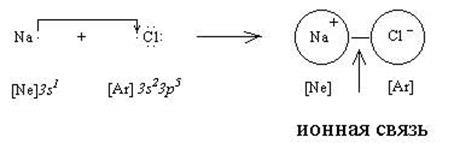
Как видно из приведенной схемы, натрий отдает хлору свой единственный валентный электрон и становится ионом Na+ с электронным строением, как у инертного газа неона. В то же время хлор, принимая один дополнительный электрон, становится ионом Cl  , у которого строение электронных оболочек аналогично аргону. Между ионами Na+ и Сl
, у которого строение электронных оболочек аналогично аргону. Между ионами Na+ и Сl  возникает электростатическое притяжение, которое называется ионной связью. Аналогичным образом можно объяснить появление ионной связи в любой паре атомов металл - неметалл.
возникает электростатическое притяжение, которое называется ионной связью. Аналогичным образом можно объяснить появление ионной связи в любой паре атомов металл - неметалл.
На основании теории ионной связи в химию было введено понятие о степени окисления, как заряда атома, появляющегося в результате образования ионной связи. Позднее, специальными физическими исследованиями, было показано, что реальные заряды на атомах не соответствуют тем зарядам, которые вытекают из теории ионной связи. Так, например, в кристаллическом хлориде натрия натрий имеет реальный заряд +0,85, а хлор -0,85 (вместо +1 и -1). Это означает, что связь в данном соединении является ионной только на 85 %, а на 15 % это ковалентная связь.
И вообще, для того, чтобы связь в веществе была “чисто” ионной, необходимо, чтобы энергия сродства к электрону неметалла была больше энергии ионизации металла. Ни для одной пары металл - неметалл это условие не выполняется. Поэтому можно говорить о том, что в соединениях, образованных достаточно сильными металлами и неметаллами химическая связь носит преимущественно ионный характер.
Ковалентная связь. Ковалентная связь возникает между атомами неметаллов. Это самый распространенный тип химического взаимодействия. Во всех органических и во многих неорганических веществах присутствует ковалентная связь.
В ходе взаимодействия двух атомов неметаллов каждый из них “стремится завершить” свою электронную оболочку посредством присоединения электронов. Это может произойти, если все или часть валентных электронов станут общими для этих двух атомов:
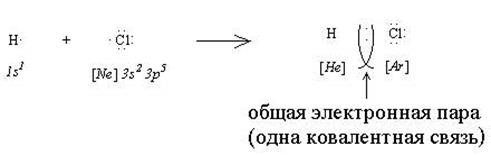
В результате такого взаимодействия образуется общая электронная пара, которая обеспечивает одну ковалентную связь. В рассмотренном примере взаимодействующие атомы отличаются по электроотрицательности (ОЭО (Н) = 2,1; ОЭО (Сl) = 3,5), поэтому общая электронная пара смещается в сторону более электроотрицательного хлора и на атомах появляются заряды (H +0,17 Cl -0,17). Такое явление называется поляризацией ковалентной связи, а сама связь называется ковалентной полярной.
Степень полярности связи характеризует дипольный момент связи. Диполем называется система из двух зарядов, одинаковых по абсолютной 
 величине и противоположных по знаку. Дипольный момент (m) - это вектор, направленный от центра отрицательного заряда к центру положительного заряда. Длина этого вектора находится по уравнению:
величине и противоположных по знаку. Дипольный момент (m) - это вектор, направленный от центра отрицательного заряда к центру положительного заряда. Длина этого вектора находится по уравнению:
½ m½ = l × ½ d ½,
где l - расстояние между положительным и отрицательными зарядами (эта величина всегда меньше, чем длина связи); d - заряд одного из атомов.
Абсолютное значение дипольного момента связи обычно выражают в единицах Дебая (1Д = 3 × 10-29 Кл × м). Например, молекулу хлороводорода можно представить как диполь Н+0,17 Cl-0,17 со значением½ m½ = 0,19 Д. Так как молекула состоит только из двух атомов, то для нее понятия дипольный момент связи и дипольный момент молекулы совпадают.
Для молекул, состоящих из 3-х и более атомов, дипольный момент молекулы равен векторной сумме дипольных моментов всех связей (по правилу параллелограмма). Так, в молекуле Н2О две связи Н-О с ½ m½ = 1,58 Д. Угол между этими связями (валентный угол) равен 105°30¢. После сложения получаем ½ m½(Н2О) = 1,84 Д.
Если взаимодействующие атомы имеют одинаковую электроотрицательность (H2; O2; NCl3; S 8 и т.д.) или отличаются по электроотрицательности очень мало (CH4; PH3; NВr3 и т.д.), то связи между ними являются ковалентными неполярными. Дипольный момент таких связей равен нулю.
Ковалентная связь может образоваться по двум механизмам: обменному и донорно-акцепторному. В случае обменного механизма при образовании связи каждый из двух взаимодействующих атомов отдает на связь один электрон. Рассмотренный выше пример взаимодействия атомов водорода и хлора соответствует этому механизму. Обменный механизм является самым распространенным способом образования ковалентной связи.
Донорно-акцепторный механизм осуществляется не так часто, причем, между двумя атомами, как правило, не может появиться более одной связи, образованной этим способом:
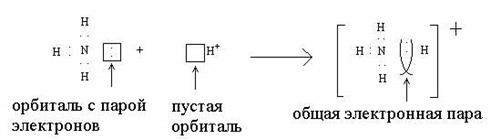
Атом, представляющий для связи орбиталь с двумя валентными электронами, называется донором (в приведенном примере это азот), а атом, дающий на связь только пустую орбиталь, называется акцептором (ион водорода).
Металлическая связь. Рассмотрим возможность взаимодействия между атомами типичных металлов (например, двумя атомами натрия) с точки зрения их “стремления к завершению” электронной оболочки:
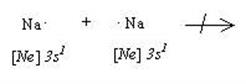
Попарное взаимодействие в этой системе невозможно, поэтому связь в данном случае не может быть ковалентной или ионной. Для появления металлической связи все атомы натрия, находящиеся в кристалле металла должны отдать по одному валентному электрону и превратиться в ионы с “завершенной” электронной оболочкой благородного газа - неона. Ионы натрия образуют кристаллическую решетку, а их валентные электроны являются теперь общими для всех атомов в кристалле. Эти общие электроны обеспечивают одну металлическую связь, охватывающую весь кристалл. В пределах кристалла валентные электроны, обеспечивающие металлическую связь, могут перемещаться практически беспрепятственно, поэтому их называют свободными (точнее - квазисвободными) или - “электронным газом”.
Металлическая связь по своей природе является ненасыщенной, так как в образовании ее может принять участие любое число атомов металлов. Она ненаправлена и многоэлектронна, т.к. ее может обеспечивать любое достаточно большое число электронов. По этим свойствам металлическая связь является противоположностью ковалентного взаимодействия, которое направленно, насыщенно и строго двухэлектронно.
Металлическая связь в “чистом” виде существует только в кристаллах щелочных и щелочно-земельных металлов. В случае d - и f - металлов, кроме металлической связи между атомами, имеет место ковалентное взаимодействие за счет валентных d- и f- электронов, а также свободных d- и f- орбиталей.
Именно наличие металлической связи в веществе определяет его особые механические (пластичность, ковкость), электрические (огромная электропроводность с отрицательным температурным коэффициентом) и оптические (высокая отражательная способность в видимой части спектра) свойства.
Подобно ионной, металлическая связь может существовать только у веществ в конденсированном состоянии (твердом или жидком).
Водородная связь.
Водородная связь является дополнительным типом химического взаимодействия. Она появляется только при взаимодействии положительно поляризованного атома водорода и отрицательно поляризованного атома очень сильного неметалла (обычно это фтор или кислород). При этом атомы водорода и сильного неметалла не должны быть связаны другими связями друг с другом.
 Примеры систем с водородными связями (обозначены точками):
Примеры систем с водородными связями (обозначены точками):

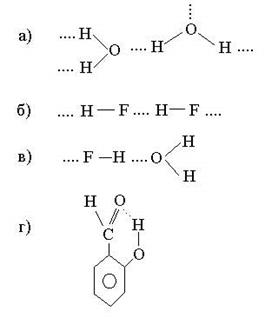
В первых трех случаях водородная связь является межмолекулярной, в последнем (салициловый альдегид) - внутримолекулярной.
Присутствие водородной связи в веществах влияет на его физические и физико-химические свойства. Расчет показывает, что если бы между молекулами воды отсутствовало сильное водородное взаимодействие, то вода имела бы температуру плавления -100 °С, а температуру кипения -80 °С.
Хорошая растворимость многих веществ в воде так же часто определяется возникновением водородных связей между растворителем (водой) и растворяющимся веществом (различные кислоты, этиловый спирт, сахар и т.д.).
Огромную роль водородная связь играет в биологических процессах. Она определяет пространственную структуру макромолекул ДНК, РНК, белков, многие процессы в живых организмах протекают с участием водородных связей.
Следует отметить, что из всех типов химической связи, водородная является самой слабой. Так, водородная связь между молекулами воды на порядок слабее ковалентной связи кислород - водород в этих же молекулах.
 2015-04-30
2015-04-30 1117
1117