ПРИГОТОВЛЕНИЕ РАСТВОРА С ЗАДАННОЙ КОНЦЕНТРАЦИЕЙ РАСТВОРЁННОГО ВЕЩЕСТВА. ОПРЕДЕЛЕНИЕ ЖЁСТКОСТИ ВОДЫ
Тверь 2008
УДК 546 (076.5)
ББК 24. 1 я 7
Приготовление раствора с заданной концентрацией растворённого вещества. определение жёсткости воды – 1-е изд. – Тверь: ТГТУ, 2008. – 15 с.
Дано краткое описание способов выражения концентрации растворенного вещества и приведено описание опытов лабораторной работы по разделу «Свойства растворов» для студентов-заочников инженерных направлений и специальностей технического университета.
Обсуждено на заседании кафедры химии и рекомендовано к печати (протокол от 19 мая 2008 г. № 8).
Составитель: Чурсанов Ю.В.
@ Тверской государственный
технический университет, 2008
Содержание
Введение. 3
1. Способы выражения содержания растворенного вещества. 4
2. Способы приготовления растворов заданной концентрации. 5
3. Определение концентрации растворенного вещества титрованием. 8
4. Экспериментальная часть Приготовление раствора гидроксида натрия заданной концентрации. Определение концентрации гидроксида натрия титрованием. Определение общей жесткости воды.. 11
Опыт 1. Приготовление раствора гидроксида натрия заданной концентрации. 11
Опыт 2. Определение концентрации гидроксида натрия методом кислотно-основного титрования. 12
Опыт 3. Определение общей жесткости водопроводной воды методом комплексонометрического титрования. 13
Контрольные вопросы.. 15
Литература. 15
Введение
Раствором называют гомогенную систему, состоящую из двух или более компонентов, состав которой может изменяться в определенных пределах. Растворы могут быть газообразными, жидкими и твердыми.
Для жидких растворов растворенными считают те компоненты, которые при обычных условиях находятся в агрегатном состоянии, отличном от раствора. Остальные компоненты представляют растворитель. Если жидких компонентов два или более, то растворителем считают вещество, присутствующее в смеси в большем количестве.
Концентрацию вещества в насыщенном растворе называют растворимостью. Часто растворимость выражают в граммах на 100 г растворителя.
Важной характеристикой раствора служит его количественный состав, определяемый концентрацией компонентов. Концентрация раствора это отношение числа частиц, либо количества вещества (моль), либо массы компонента к объему системы. Известны три способа выражения концентрации растворенного вещества: массовая концентрация (размерность г/дм3), молярная (моль/дм3), эквивалентная (моль/дм3).
При расчетах приняты следующие обозначения:
m(A) – масса вещества A (г, кг).
m(р-р); m(р-ритель) – масса раствора или растворителя (г,кг).
M(A) – молярная масса вещества А, (г/моль).
fэкв(A) – фактор эквивалентности вещества А в реакции, которая должна быть обязательно указана. fэкв = 1/z, где z – эквивалентное число, показывающее сколько эквивалентов содержится в одной формульной единице данного вещества. Например, для реакции
2NaOH + H2SO4 = Na2SO4 + 2Н2О
на 1 формульную единицу H2SO4 затрачивается 2 формульные единицы NaOH. Следовательно, z(NaOH) = 1; z(H2SO4) = 2; fэкв(NaOH) = 1/1; fэкв(H2SO4) = 1/2.
M[fэкв(А)] = M(A)×fэкв(А) – молярная масса эквивалента, г/моль;
n(A) – количество молей вещества;
n[fэкв(A)] – количество моль эквивалентов вещества А;
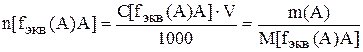
V – объем раствора (см3, дм3);
r - плотность раствора, г/см3.
 2015-05-26
2015-05-26 1917
1917