Причины коррозии металлов. Детали машин, механизмов, пожарно-технического вооружения соприкасаются с атмосферой, горючесмазочными материалами, специальными и охлаждающими жидкостями, огне- тушащими веществами. По отношению к поверхностям металлических деталей они являются внешней средой. Внешняя среда и металлические поверхности деталей не всегда нейтральны по отношению друг к другу. Под воздействием внешней среды на поверхности деталей протекают химические или электрохимические процессы, разрушающие металлические поверхности. Химическое или электрохимическое разрушение металлов в результате воздействия на них окружающей среды называется коррозией. Проблема защиты металлов от коррозии чрезвычайно важна. Убытки от коррозии в индустриально развитых странах составляют 2...4 % национального дохода.
По механизму протекания процесса различают химическую и электрохимическую коррозию.
Химическая коррозия характеризуется химическим взаимодействием металла с окружающей средой, при котором не возникает электрический ток. Примерами химической коррозии являются окисление металлов в сухом воздухе или жидкостях, не проводящих электрический ток (диэлектриках). К таким жидкостям относятся бензины, дизельное топливо, специальные жидкости. Коррозия в них называется жидкостной.
|
|
|
Химическая коррозия в результате взаимодействия металла с различными газами при высокой температуре (в цилиндрах двигателя, газоструйных вакуум-аппаратах и т. д.) называется газовой.
Электрохимическая коррозия характеризуется как химическая коррозия, при которой разрушение металла обусловлено протеканием электрического тока от одной части металлической поверхности к другой.
Детали современных машин изготовляют из сплавов различных металлов, основой которых является железо. Этим обеспечивается необходимая прочность деталей, улучшаются их противоизносные и другие свойства. В сплавах кроме того могут находиться примеси. Компоненты сплавов имеют различные электродные потенциалы. Если на поверхность детали из такого сплава (например, стали) попадает электролит, то будут образовываться микрогальванические элементы. Компоненты с более отрицательным потенциалом начнут разрушаться. Протеканию этих процессов способствует также физическая неоднородность поверхностей деталей, например, твердость, шероховатость и т. д. Это также влияет на электродные потенциалы и, следовательно, на интенсивность коррозии.
Пример. Рядом находятся кристаллы цинка и меди. Электродный потенциал Zn-анод (-0,766), Си-катод (+ 0,34 В). Если оба кристалла покроет капля электролита, то образуется микрогальванический элемент. Его напряжение будет равно разности электродных потенциалов +0,34В—(0,76 В) = 1,1 В. Металл с более отрицательным потенциалом (Zn — анодный участок) под каплей электролита будет разрушаться.Ниже рассмотрена коррозионная агрессивность внешних сред.
|
|
|
Атмосфера. В ее состав входят воздух (кислород, азот, углекислый и другие газы), а также пары воды и различные примеси (пыль, промышленные газы и т. д.). Газовый состав воздуха сравнительно постоянен, а содержание в нем влаги и примесей изменяется в широких пределах. Коррозионная активность составляющих частей атмосферы различна.
Кислород воздуха окисляет металлы. В результате чего на металлических поверхностях изделий образуются пленки окислов. Это продукт химической коррозии в сухом воздухе. Пленки окислов на цветных металлах плотные, прочные, т. е. сами защищают металл от коррозии. Пленки окислов на поверхностях деталей из стали непрочные, рыхлые и не служат защитой их от коррозии. Другие газы, входящие в состав воздуха химически неактивны и на коррозию металлов практически не влияют.
Большую роль в развитии коррозионных процессов играет влага. Влажность воздуха характеризуют содержанием в нем водяного пара. Для ее оценки используют упругость водяного пара (Па) или количество водяного пара в единице объема воздуха (г/м3). На практике в основном используют последний показатель и оценивают абсолютную или относительную влажность.
Абсолютная влажность характеризуется количеством водяных паров в единице объема воздуха. Относительную влажность оценивают отношением абсолютной влажности к максимальной (насыщенной) при данной температуре воздуха, выраженной в %. Таким образом, относительная влажность R равна:
a
R=---- 100 где а-абсолютная влажность, г/м3; А- макс. Влажность,г/м3
A
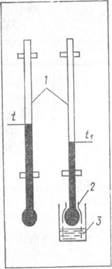
Относительную влажность измеряют специальным прибором — психрометром. Психрометры бывают разной конструкции. На рис. 3.17 показан прибор, состоящий из двух одинаковых термометров. Шарик одного из них покрыт марлей 2, концы которой опущены в сосудик 3 с водой. Температура воды и воздуха должна быть одинаковой. Этот термометр называют влажным.
Таблица 3.3. Психрометрическая таблица
|
Вследствие испарения воды с поверхности шарика показания влажного термометра всегда меньше показаний сухого термометра. Относительную влажность воздуха (табл. 3.3) определяют по специальным таблицам.
Пример. t= 12 °С, t= 9°C. Разность t—U= 3°С. По табл. для данных температур находим относительную влажность, равную 65 %.
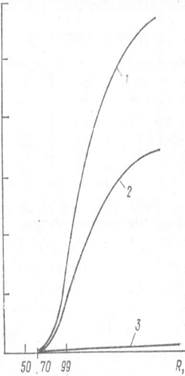
Чистая влага практически не вызывает коррозию стали (кривая 3 на рис. 3.18). При относительной влажности ниже 60 % атмосферная коррозия практически прекращается, так как влага не конденсируется с понижением температуры. Наличие в атмосфере даже небольших количеств промышленных газов (например SO2 — 0,01 %, на рис. 3.18 кривая 2) увеличивает скорость коррозии в десятки раз. В этом случае влага становится электролитом, так как сернистый газ с водой образуют сернистую кислоту, т. е. электролит. Таким образом, в присутствии электролита на металлической поверхности образуются микрогальванические элементы и развивается электрохимическая коррозия. Эта разновидность коррозии называется атмосферной коррозией.
Содержание сернистого газа в атмосфере может достигать 0,02...1,5 г/м3 и более. Опасны в коррозионном отношении хлориды (соли морской воды), а также промышленные газы. Скорость коррозии значительно возрастает, если металлические поверхности загрязнены, например, частицами пыли (кривая 1 на рис. 3.18, в атмосфере 0,01 %' S02). Между металлическими поверхностями и осевшими на них пылинками образуются микрощели. Они играют роль капилляров, облегчающих конденсацию влаги и, следовательно, протекание коррозионных процессов.
|
|
|
|
|
Рис. 3.17. Психрометр
1 — термометры; 2— чехольчик из марли; 3 — сосудик с водой
Рис. 3.18. Влияние влажности воздуха на коррозию стали
1 — металлические поверхности загрязнены (в атмосфере 0,01 % атмосфере 0,01 % S02 ); 2- в атмосфере;3-чистая влага
Огнетушащие вещества. Вода всегда содержит в растворенном состоянии различные соли, газы. Она является слабым электролитом и вызывает коррозию внутренних поверхностей цистерн, труб водопенных коммуникаций и т.д. Коррозионная активность пенообразователя ПО-1 обусловлена тем, что в его состав входит нейтрализованный керосиновый контакт Петрова. Нейтрализуют его щелочью (едким натром), которую вводят с избытком. Коррозии подвергаются детали водопенных коммуникаций пожарных автомобилей. Пенобаки, изготовленные из нержавеющей стали, не подвергаются коррозии.
Эксплуатационные материалы не вызывают коррозию металлов при эксплуатации машин. Коррозионно-активными в определенных условиях бывают дизельное топливо и бензин. Топливо содержит различные соединения серы. В дизельных топливах их количество достигает 0,2 %. В присутствии влаги они вызывают коррозию деталей топливоподающей аппаратуры.
При сгорании топлива в цилиндрах двигателя образуются различные соединения и окислы серы. Если остановка двигателя производится при низкой температуре охлаждающей жидкости, то на поверхности камер сгорания и гильз цилиндров осаждается влага, образуются серная и сернистая кислоты. Они и вызывают электрохимическую коррозию гильз цилиндров дизелей. Поэтому не рекомендуется продолжительная работа дизелей на пониженном тепловом режиме и низких частотах вращения коленчатого вала.
|
|
|
В отработавших газах карбюраторных двигателей также содержится некоторое количество окислов серы. Но в этих двигателях цилиндры изготовлены из коррозионно-стойких чугунов, поэтому в них коррозия менее опасна, чем в дизелях.
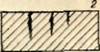
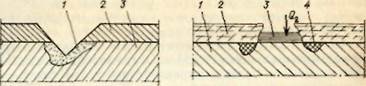
Формы коррозионных разрушений. Неоднородность металла деталей, разная интенсивность коррозионных процессов металлов, составляющих сплавы, являются причиной образования некоторых форм коррозионных разрушений. В зависимости от соотношения анодных и катодных участков на поверхности детали коррозия может быть сплошной или местной (рис. 3.19). Местная коррозия бывает нескольких типов: пятнами 1, точками 2, язвами 3. Эти формы коррозионных разрушений встречаются наиболее часто.
|

|

Рис. 3.19. Формы коррозионных разрушений
I - пятнами; 2- точками в глубь металла: 3 -язвами
Защита металлов от коррозии. Защита металлических изделий от коррозии достигается торможением коррозионных процессов, осуществляемым различными методами (рис. 3.20).
Повышение коррозионной стойкости изделий достигается использованием легированных металлов, а также подбором металлов для соприкасающихся деталей с близкими значениями электродных потенциалов.
Легирование заключается в том, что в основной металл для повышения его коррозионной стойкости добавляют другие металлы, например, в железо добавляют хром, никель и т. д.
Повышение коррозионной стойкости обеспечивается при проектировании пожарной техники.
| Рис. 3.20. Способы защиты металлических изделий от коррозии |

|
Уменьшение коррозионной агрессивности среды. Этот метод широко используют при эксплуатации пожарной техники. Так, повышение антикоррозионных свойств эксплуатационных материалов достигается введением в них антикоррозионных присадок (добавок). Такие же присадки вводят в смазочные масла при их изготовлении.
Для предотвращения коррозии деталей систем охлаждения к воде добавляют трехкомпонентную присадку. В ее состав входят хромпик калиевый, К2СГ2О2, нитрит натрия NaN02 и тринатрийфосфат Na3P04. Компоненты добавляют в воду по 0,05 % (по массе) от количества заправляемой воды. Присадка предотвращает отложение накипи и защищает металлические детали системы охлаждения от коррозии.
Торможение процессов коррозии достигается поддержанием относительной влажности защищаемых изделий ниже 60 %. В этом случае при любых возможных суточных изменениях температуры влага не выпадет в виде росы.
|
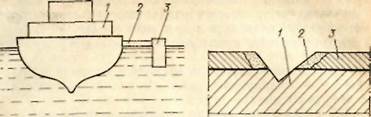
Рис. 3.21. Анодная (протекторная) зашита
1- катод: 2- кабель: 3- протектор
Рис. 3.22. Коррозия оцинкованной стали 1- сталь: 2-разрушенный слой цинка; 3-слой цинка (пленка)
|
Рис. 323. Коррозия луженой стали
1- ржавчина (коррозия стали); 2- слой олова; 3-сталь
Рис. 3.24. Коррозионные разрушения под слоем смазки
1- сталь; 2- слой смазки; 3-капля влаги; 4- очаги коррозии
Следовательно, на металлических поверхностях изделий будет отсутствовать электролит и не будет развиваться электрохимическая коррозия. Для предотвращения коррозии многие изделия хранят в полиэтиленовых чехлах, помещая в них влагопоглотитель (например, силикагель Si02-3H20). Паропроницаемость полиэтиленовой пленки и интенсивность поглощения влаги силикагелем таковы, что внутри чехла поддерживается относительная влажность в пределах 40...60 %•
Электрохимическая защита металлических изделий может осуществляться методом анодной или катодной защиты.
Анодную защиту выполняют в соответствии со схемой, показанной на рис. 3.21. К катоду 1 при помощи кабеля 2 подсоединяют протектор 3. Протектор изготовляют из сплава цинка, магния и других металлов. Электродный потенциал железа 0,44 В, а протектора -0,76 В (протектор всегда имеет отрицательный электродный потенциал). Таким образом, в воде образуется гальванический элемент, в котором будет разрушаться протектор. Протекторная защита применяется для крупных объектов - нефтехранилищ, судов и т. д. В речной воде она малоэффективна.
Катодная защита отличается от анодной тем, что анодом служит сталь. Защищенную конструкцию искусственно делают катодом путем наложения электрического потенциала от источника постоянного тока. Этот метод применяют в случаях, когда электропроводность среды невелика (речная вода, грунт).
Изоляция металлических поверхностей изделийотвнешней среды осуществляется различными способами: металлическими и неметаллическими покрытиями, а также специальной обработкой поверхностей.
Металлические покрытия подразделяются на анодные и катодные. Анодными называются покрытия металлами более электроотрицательными, т. е. более активными, чем защищаемый металл. К анодным покрытиям относится цинкование. Слой цинка 3 (рис. 3.22) защищает стальную деталь 1, т. е. его потенциал более отрицателен. В случае нарушения целостности цинкового слоя (например, царапины) будет разрушаться слой цинка 2.
Катодными называются покрытия металлами менее активными, чем защищаемый металл. К ним относятся никелирование, меднение, лужение (покрытие оловом) стали (рис. 3.23). В этих случаях покрывающий металл механически защищает сталь. Если слой олова 2 будет нарушен, то разрушаться будет сталь.
Эффективно нанесение металлических порошков. Такие покрытия позволяют уменьшить потери от коррозии в 5...6 раз.
Покрытие при помощи электродуговой металлизации конструкций обеспечивает защиту изделий от коррозии на протяжении 20...30 лет. Лучшие лакокрасочные материалы эффективны до 7 лет.
Неметаллические покрытия - жидкие масла, консистентные смазки, краски, лаки. Их эффективность достаточно велика. Однако эти покрытия непрочные, их целостность может быть легко нарушена.
Моторные и трансмиссионные масла обладают хорошими антикоррозионными свойствами. Недостаток масел состоит в том, что они стекают с наклонных и вертикальных поверхностей деталей. Для восстановления слоя масла на деталях при длительном хранении машин валы их механизмов следует прокручивать вручную.
Консистентные смазки (УС-2, УСс, УТ) надежно защищают от коррозии эксплуатируемые детали механизмов. Для защиты деталей, хранящихся на складе, применяют технический вазелин (УН) или пушечную смазку (УНЗ). Смазки наносят на поверхность деталей тонким ровным слоем и упаковывают детали в бумагу.
При наличии в слое смазки 2 (рис. 3.24) пузырьков воздуха или разрушении этого слоя влагой будет окисляться защищаемый металл 1. Окисленный слой металла становится более электроположительным, поэтому коррозия 4 будет развиваться под слоем краски. Обнаружить ее можно только после расконсервации деталей.
Краски и лаки. Их применяют очень широко для защиты деталей пожарных машин.
При эксплуатации машин слой краски часто повреждается. При этом коррозия происходит под слоем краски, у мест разрушения ее слоя. Постепенно развиваясь, продукты коррозии (ржавчина) ослабляют прочность соединения слоя краски с металлом. Краска осыпается, поэтому при обнаружении на окрашенной поверхности повреждений необходимо очистить ее от краски, удалить коррозию. После этого надо закрасить разрушенные места.
Изложенные выше методы защиты металлов от коррозии используют при консервации пожарной техники.
 2015-05-26
2015-05-26 2629
2629
