В конце 19 и начале 20 века было установлено, что атом состоит из ядра и движущихся вокруг него электронов. Размер атомов порядка 10-9-10-10 м, а размеры ядра @ 10-15 м. То есть большая часть массы всего атома (>99,95%) сосредоточена в ядре. В обычном состоянии атомы электрически нейтральны, по крайне мере на расстояниях значительно превышающих их размеры, а это возможно лишь в том случае, если в состав атома входят другие частицы положительно заряженные, которые компенсируют отрицательный заряд электронов. В 1911 г. английский физик Э.Резерфорд, на основе выполненных экспериментов, предложил именно такую ядерную (планетарную) модель атома. Эксперименты были выполнены в связи с исследованиями рассеяния a-частиц, движущихся со скоростью порядка 107 м/с, имеющих положительный заряд равный двум элементарным зарядам и массу в 7350 раз большую массы электрона. Проходя сквозь фольгу толщиной 0,5-1,0 мкм частицы попадали на экран покрытый люминесцентным веществом и каждый удар вызывал кратковременную вспышку (сцинтилляцию), которые наблюдались с помощью микроскопа (рис.76). Большинство a-частиц проходило сквозь фольгу без заметных отклонений от первоначального направления, некоторые отклонялись на небольшой угол, однако наблюдались и частицы, траектории которых заметно изменялись.
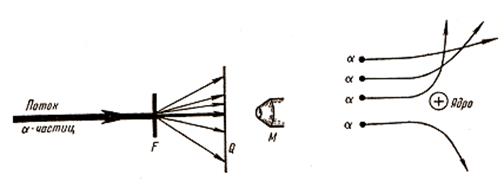
Рис.76
Из этих экспериментов и следовало, что a-частицы, имеющие положительный заряд 2е, достаточно большую массу и скорость, могли изменить свое первоначальное направление движения только за счет действия силы Кулона. Теоретические расчеты Э.Резерфорда хорошо согласовывались с экспериментальными данными. Анализ результатов позволил установить также, что заряд q ядра атомов фольги (из разных материалов), выраженный в элементарных зарядах (зарядах электрона е), равен порядковому номеру Z химического элемента в периодической системе Менделеева
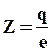 , (160)
, (160)
и равен заряду всех электронов в электронной оболочке атома.
В соответствии с моделью атома Резерфорда электроны должны вращаться вокруг ядра (с учетом теоремы Ирншоу), то есть двигаться с ускорением, но согласно законам классической электродинамики, они должны непрерывно излучать электромагнитные волны и, следовательно, терять энергию. Постепенно электрон должен был бы приближаться к ядру, частота его излучения должна была бы изменяться непрерывно, то есть спектр излучения должен был бы быть непрерывным а атом неустойчивым соединением. Однако атомы устойчивы и их излучение имеет линейчатый спектр, причем каждому атому соответствует вполне определенный, характерный только для него спектр, Это было установлено в результате многочисленных экспериментов, а также была определена одинаковость линейчатых спектров излучения и поглощения отдельных атомов, что позволило сделать вывод о парциальных количествах энергии (квантах), излучаемой или поглощаемой.
Отсюда следует, что атом может находиться только лишь в определенных (дискретных) энергетических состояниях. Исходя из таких предположений датский физик Н. Бор в 1913 году на основе модели атома Резерфорда предложил более совершенные представления о строении атома, сформулировав их в виде постулатов (постулаты Боры):
1. Электроны могут двигаться в атоме только по строго определенным орбитам, радиусы которых определяются условием квантования
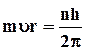 , (161)
, (161)
где m = 9,11·10-31 кг – масса электрона, υ – скорость его движения по орбите радиуса r, n - квантовое число (n= 1, 2, 3…)
h = 6,63·10-34 Дж.с – постоянная Планка
 2015-05-30
2015-05-30 1378
1378








