Термин «антисептика» (греч. anti - против, sepsis - гниение) впервые предложил английский ученый И. Прингл в 1750 г. для обозначения противогнилостного действия минеральных кислот.
В настоящее время под антисептическими мероприятиями подразумевают обработку операционной и окружающих областей, а также поверхности любых предметов, соприкасающихся с ними, препаратами, обладающими антимикробным действием (антисептиками). Такое определение приведено в основном нормативном акте (DAHZ), регламентирующем требования по обеспечению инфекционной безопасности при осуществлении любых мероприятий в рамках профилактики и терапии заболеваний пародонта.
Использование антимикробных препаратов наряду с механическим удалением мягкогоо и твердого зубного налета (с использованием ручных инструментов или звукового, ультразвукового, пескоструйного и лазерного оборудования) является основным мероприятием, направленным на уничтожение болезнетворных бактерий, содержащихся в слюне, на поверхности слизистой оболочки или в более или менее глубоких пародонтальных карманах.
При использовании антисептиков в рамках профилактики заболеваний пародонта следует избегать любого повреждения целостности слизистой оболочки, что позволяет предотвратить развитие локальной инфекции или бактериемии.
Для выявления возможных факторов риска перед началом терапии необходимо составить подробный анамнез пациента. Результаты многочисленных исследований свидетельствуют о том, что воспалительные и иммунологические механизмы возникновения и развития Parodontius ma-ginalis являются факторами риска для возникновения различных заболеваний сердечно-сосудистой системы. В связи с этим необходимо тщательно подбирать антибиотики, используемые при терапии заболеваний пародонта.
Важнейшим условием обеспечения инфекционной безопасности является тщательная и регулярная дезинфекция рук, которую необходимо осуществлять как до, так и после проведения каких-либо процедур, в том числе и при использовании перчаток.
При проведении хирургического вмешательства необходимо выполнять все соответствующие более жесткие требования по дезинфекции рук.
При стандартной дезинфекции необходимо использовать специальные препараты на спиртовой основе, которые имеют:
разрешение на использование в медицине;
- сертификат DGHM;
- свидетельство HBV/HCV/HIV, подтверждающее их антимикробное действие.
Дезинфицирующие препараты должны находиться в одноразовой упаковке. Многократное использование емкостей с такими растворами не допускается.
В хирургии при обработке рук рецептурой «Лереомур» (смесь «С-4»), их моют водой с мылом (без щетки) в течение 1 минуты. После этого их ополаскивают водой для удаления мыла и вытирают насухо стерильной салфеткой. Затем обрабатывают в течение 1 мин рецептурой «С-4» в эмалированном тазу, после чего вытирают стерильной салфеткой и надевают стерильные перчатки.
При обработке хлоргексидином после предварительного мытья рук с мылом и последующим протиранием стерильной марлевой салфеткой производят их обработку ватным тампоном, смоченным 0,5 % спиртовым раствором хлоргексидина в течение 2-3 мин. Из современных дезередств используют АХД-2000 специалъ. Руки моют теплой проточной водой и туалетным мылом в течение 2 мин, высушивают стерильной марлевой салфеткой, затем 5 мл препарата наносят на кисти рук и втирают в кожу в течение 2,5 мин. После этого снова наносят 5 мл препарата на кисти рук и втирают в течение 2,5 мин. Время обработки составляет 5 мин.
Для обработки кожи рук и операционного поли разрешено также использовать «Алшюдерм», «Октемидерм», «Диас-20», «Велтосепт», «Штасепт-тинктура», «Поли алкоголь ХАУТ антисептикум», «Лизании ОП», «Октеиисепт», «Пливасепт синий», «Триформин Д», «Изосепт», «Сагросепт», «Октониман» в соответствии с методическими указаниями к ним.
Для гигиенической обработки рук медперсонала и обработки рук хирургов фирмой «Джонсон энд Джонсон Медикал Лтд», выпускается жидкость «Манопронто». Удобно и практично применять средство «Биотензид» этой же фирмы, эффективное против бактерий, вирусов (включая сывороточные гепатиты и ВИЧ), микобактерий туберкулеза и грибов.
Для снижения обсемененности полости рта используют следующие антисептики: «Октенисепт», «ДентаСОЛ», водный раствор хлоргексидина биглюконата, а также 1:1000 раствор марганцовокислого калия, приготовленный ex tempore, 1:5000 раствор фурациллина и 0,5 % раствор перекиси водорода.
Результаты клинических исследований показывают, что наиболее эффективное воздействие на микрофлору полости рта оказывают препараты на основе цетилпиридинхлорида, хлоргексидина, остенидина, PVD-uoda.
В отдельную группу выделяются препараты, препятствующие образованию бактериального налета, в состав которых, помимо вышеперечисленных веществ, входят алкалоиды и фторсодержащие соединения.
Эти препараты наносятся сверху на обрабатываемую поверхность полости рта с помощью тампонов, путем разбрызгивания или полоскания, а также вводятся непосредственно в пародонтальный карман с помощью специальных игл. Время воздейшвия таких препаратов в зависимости от способа нанесения и рекомендаций производителя составляет от 30 до 120 сек.
Индивидуальная гигиена. Весь медперсонал, который имеет прямой или косвенный контакт а пациентами, во врачебном кабинете или вне его должен тщательно соблюдать правила личной гигиены. Строгие гигиенические меры в значительной степени уменьшают перенос живых патогенных микроорганизмов, находящихся в окружающей среде.
Контрольные вопросы:
1. Перечислите принципы рациональной антибиотикотерапии.
2. Дайте характеристику отельным группам антибактериальных препаратов и назовите показания к их применению в стоматологии.
3. Дайте определение понятию «дезинфекция».
4. Дайте определение понятию «стерилизация».
5. Перечислите известные Вам методы дезинфекции и стерилизации.
6. Как следует проводить дезинфекционную обработку и стерилизацию стоматологического инструментария?
7. Назовите антисептики, применение которых разрешено в стоматологии.
8. ПРАВИЛА СОБЛЮДЕНИЯ БИОЛОГИЧЕСКОЙ БЕЗОПАСНОСТИ ВРАЧОМ-СТОМАТОЛОГОМ
Для профилактики профессиональных заражений в стоматологических учреждениях, в первую очередь, необходимо проведение первичного (при приеме на работу) и последующих регулярных медицинских освидетельствований состояния здоровья медицинского персонала (кратность и перечень специалистов регламентируются приказом и инструкциями Министерства здравоохранения). Работающему медицинскому персоналу проводится:
♦ плановая вакцинация и ревакцинация против дифтерии и вирусного гепатита В;
♦ экстренная вакцинация против вирусного гепатита В в случаях возникновения травматизма, связанного с риском инфицирования;
В целях охраны труда и предупреждения инфицирования персонала стоматологических поликлиник, отделений и кабинетов, а также для предупреждения инфицирования пациентов каждый сотрудник стоматологического учреждения должен неукоснительно соблюдать следующие правила биологической безопасности;
1. Работать в санитарной одежде (халат, костюм, шапочка, маска), дезинфекция и стирка которой производится централизованно. В необходимых случаях использовать влагонепроницаемую одежду для защиты тела от возможного попадания брызг крови или жидкого отделяемого полости рта. Маски, закрывающие рот и нос, необходимо менять после каждого пациента.
2. Соблюдать правила личной гигиены, мыть руки перед и после любого контакта с пациентом, обрабатывать антисептиками, использовать одноразовые перчатки для каждого пациента.
3. При обработке зубов, работе в полости рта врач должен одевать защитные очки, щиток для предотвращения возможного попадания брызг крови или жидкого отделяемого полости рта в лицо. После каждого использования их дезинфицируют.
4. Мелкие ссадины и раны на пальцах и кистях необходимо заклеивать лейкопластырем, пользоваться напальчниками. В кабинетах приема вести «Журнал учёта микротравм».
5. При загрязнении кожных покровов кровью (жидким отделяемым полости рта) пациента кожу обрабатывают дезинфицирующим раствором или 70 С спиртом. При нарушении целостности кожных покровов не останавливают кровотечение, а выдавливают кровь из раны, промывают рану водой и обрабатывают 5 % спиртовым рас-твором иода.
6. При попадании крови (отделяемого полости рта) пациента на слизистые рта, их обильно прополаскивают 70° С спиртом или 0 05 % раствором марганцовокислого калия. При попадании на коныонктиву глаза их промывают 0,05 % раствором марганцовокислого калия.
7. Для каждого пациента врач должен использовать индивидуальный набор стерильных/одноразовых стоматологических инструментов (повторное использование набора или отдельных инструментов из него запрещается).
8. Предметы и оборудование, используемые для нескольких больных должны подвергаться адекватной очистке и дезинфекции.
9. Необходимо производить своевременную смену фильтров при использовании отсосов, улавливающих аэрозоли с микробами на месте их образования (при отсутствии или несовершенстве фильтров отработанный загрязненный воздух приводит к значительной контаминации всех предметов и аппаратуры в кабинете микрофлорой полости рта пациентов).
10.Все образцы лабораторных анализов следует рассматривать как потенциально инфицированные, делать забор, сохранять и доставлять их в микробиологическую лабораторию в соответствии с техникой микробиологической безопасности, П.Спецодежду, белье, запачканное кровью и выделениями больного, следует рассматривать как потенциально инфицированные, подлежащие немедленной дезинфекции. 12. Сразу после применения помещать использованные шприцы в специальный контейнер для утилизации острых предметов, никогда не снимать со шприцов иглодержатели с иглами и не производить никаких манипуляций с использованными иглами!
Особое внимание следует обратить на утилизацию опасных медицинских отходов. Отходы, образующиеся в ЛПУ, имеют различную степень эпидемиологической и экологической опасности. Для возникновения ВБИ имеют значение отходы 4 группы (Г) - медицинские отходы, опасные в эпидемиологическом отношении. К этой группе относятся использованный перевязочный материал, одноразовое операционное белье, одноразовые шприцы, иглы, мелкий стоматологический инструментарий. Эти отходы образуются в стоматологических кабинетах, процедурных, перевязочных и операционных.
Требования к переработке опасных медицинских отходов, включают два основных положения:
1) невозможность повторного использования медицинских материалов;
2) их надежная дезинфекция, которая включает в себя требование биологической безопасности материала после его переработки или уничтожения. Обычно это достигается тщательной стерилизацией, которая определяется как полное уничтожение или инактивация всей флоры, остающейся на использованных инструментах, предметах, имуществе и т.д.
Уничтожению подлежат медицинские отходы, т.е. все виды расходных материалов, накапливающиеся в процессе работы медицинских учреждений, при помощи физических, химических или термических методов обработки.
Все отходы, образующиеся в этих подразделениях после дезинфекции должны собираться в одноразовую твердую или мягкую упаковку. После заполнения на У4 удаляется воздух, осуществляется герметизация. Сбор острого инструментария (иглы, мелкий стоматологический инструментарий), прошедшего дезинфекцию, осуществляется отдельно от других видов отходов в одноразовую твердую упаковку. Открытое хранение и контакт медперсонала с отходами группы Г не допустимы. Обезвреживают отходы группы Г централизованным или децентрализованным способом. В настоящее время различают следующие методы утилизации отходов:
- механическая обработка (обработка давлением и измельчение),
- термическая обработка (наиболее часто применяются автоклавы);
- сжигание;
- микроволновая обработка;
- электротермическая обработка (низкочастотным излучением);
- обработка при помощи инфракрасного излучения;
- химическая обработка или дезинфекция
Существующее состояние данной проблемы ведет к целому ряду грубых нарушений требований противоэпидемического режима. Нарушением является отсутствие одноразовой тары (пакеты, баки) для упаковки медицинских отходов, а так же отсутствие простой и надежной технологии её герметизации. Зачастую отсутствуют специально отведенные помещения (площадки) и емкости (контейнеры) для временного хранения отходов. Не организована безопасная транспортная цепь, исключающая контаминацию инфицированными медицинскими отходами персонала и пациентов. Резкое увеличение объема и эпидемиологической опасности отходов в медицинских учреждениях, за счет внедрения нозых подходов к оказанию медицинской помощи, в том числе применения готовых лекарственных форм и предметов разового использования требует совершенствования и1089 системы уничтожения отходов на месте.
Требования по обеспечению высокого уровня гигиены на рабочем месте стоматолога должны учитывать не только практикующие стоматологи в своей ежедневной практике, но и разработчики новых технологии, а также производители различных инструментов, материалов и оборудования для стоматологического кабинета. «Свод правил гигиены и методические рекомендации» традиционно выпускаются в Германии (DAHZ).
Контрольные вопросы:
1. Перечислите правила биологической безопасности для сотрудников стоматологических учреждений.
2. Как следует утилизировать медицинские отходы на рабочем месте?
9. ПРИМЕНЕНИЕ БИОЛОГИЧЕСКИХ ПРЕПАРАТОВ В СТОМАТОЛОГИИ
Неблагоприятная экологическая обстановка, возрастание стрессовых воздействий, нерациональная антибиотикотерапия создают условия для повсеместного распространения у людей дисбактериоза, активизации хронических бактериальных инфекций, аллергизации организма взрослых и детей. Дисбактериоз и иммунодефицит существенно влияют на длительность и тяжесть острых и хронических заболеваний, в т.ч. заболеваний полости рта, усложняют и удорожают их диагностику и лечение.
Бактериальная флора зубного налета рассматривается в настоящее время как первичный фактор, вызывающий поражения пародонта при гингивите и пародонтите. Исследования роли бактериальной колонизации в развитии и течении заболеваний пародонта продолжаются уже более 100 лет. Подчеркивая наступление новой эры пародонтальной микробиологии, Socransky S.S. и Haffajee A.D. (1992) предложили новую «формулу» деструктивных поражений пародонта, в соответствии с которой заболевания пародонта следует рассматривать как сложный патофизиологический процесс, состоящий из нескольких звеньев:
Поражения пародонта = бактериальный патоген + чувствительный организм + дефекты нормальной микрофлоры.
Одно из ведущих мест в системе антимикробной защиты макроорганизма принадлежит аутофлоре слизистых оболочек. От её состояния и способности противостоять внешним воздействиям во многом зависит колонизация патогенными и условно-патогенными микроорганизмами. Одну из главных ролей в поддержании постоянства микробного состава играет свойственный постоянной микрофлоре антагонизм по отношению к патогенным и условно-патогенным микробам. Постоянная флора служит для организма «биологическим барьером», препятствующим размножению случайной флоры. Это - эволюционно" выработанное, физиологически необходимое средство защиты от инфекции. Среди представителей нормального микробиоценоза полости рта наибольшая физиологическая значимость принадлежит роду Lactobacillus, который представлен здесь более чем 10 видами.
В процессе филогенеза выработались механизмы, защищающие макроорганизм от действия случайной микрофлоры. Одновременно происходила адаптация определенных микробных видов к обитанию в полости рта. Между микрофлорой и макроорганизмом установилось состояние биологического «равновесия», т.е. эубиоз.
Воспалительные заболевания тканей пародонта, как правило, сопровождаются дисбиозом полости рта, выраженность которого соответствует степени поражения пародонта.
Изменение биологического равновесия в полости рта при развитии воспалительно-деструктивных процессов в пародонте
Компенсаторные возможности симбионтной микрофлоры небеспредельны, и под влиянием различных факторов динамическое равновесие между нормальной и патогенной флорой полости рта может быть нарушено. Так, расстройство глотания, жевания и слюноотделения всегда приводит к нарастанию количества патогенных микроорганизмов в полости рта. Таким же образом действует и нарушение нормального типа дыхания (через нос), сопровождающееся сухостью слизистой оболочки рта. Поэтому количество микробов во рту резко увеличивается при насморке, аденоидном типе дыхания, ангине. Нарушение секреции слюнных желез вызывает интенсивное размножение микроорганизмов.
Резкое общее увеличение числа микроорганизмов происходит при наличии в полости рта аномалий и дефектов, способствующих задержке пищевых остатков и затрудняющих вымывание микроорганизмов слюной. Это наблюдается при врожденных дефектах челюстно-лицевой области, множественных кариозных поражениях, образовании пародонтальных карманов, некачественном протезировании, а также при воздействии общей патологии: при изменении реактивности организма, эндокринных заболеваниях и т. д. В этой ситуации наступает резкое угнетение представителей постоянной флоры. Развивается дисбактериоз. Понятие дисбактериоза введено в медицину в 1916 г. немецким ученым A. Nissle, который трактовал дисбактериоз только как изменение концентрации Е. coli. В настоящее время термином «дисбактериоз» обозначают качественные и/или количественные изменения нормальной микрофлоры, возникающие в результате воздействия на организм различных факторов экзогенного или эндогенною характера, влекущие за собой выраженные клинические проявления со стороны макроорганизма или являющиеся следствием развития каких-либо патологических процессов в организме.
Возникновению и развитию дисбактериоза полости рта способствуют хронические заболевания и нарушения функций органов пищеварения. Возникая как симптом какого-либо заболевания, дисбактериоз в дальнейшем отягощает его течение и усугубляет хрониза-цию процесса.
Микробиоценоз слизистой оболочки рта считается экологической системой, чувствительной к неблагоприятным изменениям окружающей среды. В экологически неблагоприятных биотопах в микрофлоре полости рта по сравнению с нормой уменьшается количество лакто-бактерий и увеличивается концентрация стафилококков и грибов рода Candida.
Нередко изменение бактериоценоза полости рта является следствием включения в комплекс лечения пародонтита антибиотиков. Нерациональное применение препаратов может оказать негативное воздействие на облигатных представителей аутофлоры полости рта и местные факторы антибактериальной защиты. Основной задачей при разработке схемы лечения при заболеваниях пародонга является грамотное решение вопроса о системном или локальном применении АБП. Используемые в стоматологической практике различные антимикробные и антисептические препараты тотально воздействуют на все звенья микробиоценоза полости рта. Однако их бактериостатический эффект сохраняется очень кратковременно, при этом часто вследствие антибактериального лечения изменяется количественный и качественный состав микрофлоры, наблюдается повышение устойчивости патогенной микрофлоры к антибиотикам. Так, лечение АБП приводит к быстрому изменению количественного и видового состава микрофлоры с преобладанием дрожжеподобных грибов Candida. Лишаясь конкурентов и антагонистов, фибы получают возможность к ускоренному росту, адгезии и колонизации. Действием нерациональной антибиотикотерапии часто объясняется увеличение высеваемости в процессе заболевания в смешанной слюне бактерий рода Proteus. В результате лечения антибиотиками повышается также устойчивость штаммов протея к антибиотикам.
На фоне выраженного роста патогенных и УПМ концентрация представителей нормальной микрофлоры уменьшается. Поэтому применение в ходе лечения пародонтита средств, способствующих восстановлению нормальной микрофлоры полости рта и, в частности, тканей пародонта рассматривается как необходимое условие повышения эффективности лечения. Перспективным в связи с этим является использование микробных биопрепаратов, действующим началом которых являются штаммы представителей нормальной микрофлоры с высокими антагонистическими, ферментативными и иммуностимулирующими свойствами.
Классификация биологических препаратов. В настоящее время к наиболее распространенным средствам поддержания баланса нормальной микрофлоры организма на оптимальном уровне относятся биологические препараты. Согласно R. Simmering и М. Blaut (2001) биопрепараты должны отвечать определенным требованиям и обладать заданными свойствами:
- быть симбионтными именно для человеческого организма; не утрачивать необходимую концентрацию в процессе технологического производства;
- не перевариваться желудочным соком и желчными кислотами;
- иметь достаточные для данного биотопа адгезивные свойства;
- в заданном биотопе действовать максимально долго;
- вырабатывать антибиотические вещества;
- модулировать иммунные реакции;
- положительно влиять на метаболические процессы в организме (регулировать холестериновый обмен, стимулировать витаминообразование).
Биопрепараты, принимаемые энтеральным путем и предназначенные для нормализации микробиоценоза, ученые Центрального НИИ микробиологии и эпидемиологии им. Габричевского в России предложили разделить на несколько групп в зависимости от природы составляющих компонентов:
1) вакцины;
2) биологически активные добавки;
3) эубиотики;
4) пробиотики;
5) пребиотики;
6) бактериофаги.
Вакцины представляют собой препараты из микроорганизмов или их антигенов, используемые для искусственного создания активного иммунитета против определенных видов микроорганизмов или выделяемых ими токсинов. В стоматологии примером вакцины является препарат имудон (производство Solvay Farma, Франция), в последнее время широко используемый при лечении заболеваний пародонта и слизистой оболочки рта. Имудон изготовлен из антигенов 13 штаммов наиболее часто встречаемых бактериальных и грибковых возбудителей патологических процессов в полости рта и представляет собой поливалентный комплекс антигенов. Наличие антигенов позволяет препарату «тренировать» местный иммунитет ротовой полости. Имудон стимулирует память иммунных клеток, готовя их к предстоящей встрече с болезнетворными микробами. Препарат может быть успешно использован и для профилактики воспалительных заболеваний полости рта.
Фирмой Solvay Farma выпущена ещё одна ассоциированная вакцина, содержащая антигенные детерминанты 19 штаммов - препарат ИРС-19, Вызывая немедленную мобилизацию защитных механизмов в слизистой оболочке и запуская эффективную продукцию антител, препарат повышает также фагоцитарную активность макрофагов ротовой полости, выработку лизоцима и интерферона. Препарат применяется при воспалительных заболеваниях ротовой полости, верхних дыхательных путей и заболеваниях пародонта.
Биологически активные добавки - это бифидосодержащие лечебно-диетические продукты питания, предназначенные для улучшения работы желудочно-кишечного тракта и восстановления микрофлоры кишечника. К ним относится эколакт - лечебно-профилактический напиток из соков овощей, заквашенных лактобактериями, который обладает антиоксидантной активностью и антимутагенным эффектом, кисломолочные продукты типа «бифилайф», «био-кефир», «кефир BFB», ацидофильная паста, йогурты, в состав которых входят молочнокислые бактерии разных видов.
Эубиотики - это бактериальные препараты, действующим началом когорых являются живые лиофильно высушенные культуры микроорганизмов - представителей нормачьной микрофлоры.
Использование эубиотиков - это типичный пример заместительной терапии. Эубиотиками являются:
- бифидумбактерин - микробная масса бакгерий Bifidobacterium bi-fidum,
- ацшакт - биомасса представителей 3 штаммов Lactobacillus acidophilus,
- яактобактерин - микробная масса бактерий Lactobacillus planta-гит и L. fermentum.
- колибактерин - микробная масса Е. coli;
- бифилиз - комбинация лиофильно высушенной биомассы бифи-добактерий и лизоцима;
- линекс - лиофилизироваиный препарат живых бактерий Lactobacillus acidophilus, Bifidobacterium infantis и Streptococcus faecium.
Известны капсулированные эубиотики производства США - фло-радофилюс 3000 (производства компании Amrion) и еита-баланс (производства компании New Spirit Naturals).
Исследования показали, что под влиянием действия эубиотиков из бифидо- и лактобактерий усиливается активность клеток моноцитарно-макрофагального ряда, увеличивается продукция сывороточных иммуноглобулинов и интерферона, стимулируются реакции Т-клеточного иммунитета. Молочнокислые бактерии Lactobacillus acidophilus и L.casei стимулируют иммунные реакции, включая фагоцитоз, активность натуральных киллеров и продукцию антителообра-зующих клеток. Как известно, клеточная стенка многих грамположительных бактерий, в том числе лакто- и бифидобактерий, содержит мурамилдипептид (МДП), высвобождение которого способствует активации Т- и В-лимфоцитов и макрофагов, продукции иммуноглобулинов. Отмечая многообразные механизмы лечебно-профилактического действия бактерийных препаратов, нельзя утверждать, что какие-либо из них являются главными, а какие-то - второстепенными. При различных острых и хронических заболеваниях терапевтическое действие в одних случаях может достигаться преимущественно за счет антагонистических свойств бацилл, в других - за счет продукции ими ферментов, в третьих - за счет активации защитных реакций. Но, как правило, участие в процессе одновременно принимают несколько факторов.
Пробиотики - препараты в основном микробной природы, действующим началом которых являются ферментные системы, обладающие способностью подавлять рост патогенных и условно-патогенных микроорганизмов и принимающие участие в процессе пищеварения.
Пробиотики являются активаторами роста нормальной микрофлоры. К ним относятся: энтерол (производства компании Sanofi-Chinoin, Франция), бактисубтил (Marion Merrel Dow, США), флонивин БС (JCN, Galenic, Югославия), биоспорин (Центр Военно-технических проблем, Россия).
Механизм действия биоспорина реализуется за счет содержания в нем бактерий рода Bacillus. При этом часть живых бацилл (не менее 50%) находится в споровой форме. Спорообразующие бактерии, хотя и не обладают явной способностью колонизировать слизистую оболочку, адаптируются и вегетируют на ней от 1 до 3 суток. Ферменты, высвобождающиеся при прорастании спор, вызывают непосредственный лизис клеточной стенки протея, кишечной палочки, патогенного стафилококка и грибов рода Candida. Препарат существенно усиливает защитные реакции организма - повышает фагоцитарную активность лейкоцитов, индуцирует продукцию эндогенного интерферона и ли-зоцима.
Пребиотики - это неперевариваемые в кишечнике пищевые вещества, обладающие способностью стимулировать рост нормальной микрофлоры. К данной труппе относят препарат хилак-форте.Хилак- форте (производства компании Ludwig Merckle GmgH, Австрия) выпускается в виде оральных капель и представляет собой стерильные продукты обмена грамположительных и грамотрицательных бактерий - симбионтов кишечной микрофлоры.
Лактулоза - синтетический дисахарид, выпускаемый под названиями нормазе, лактофальк, дюфалак, портолак. Препарат ингибирует рост сальмонелл в кишечнике, уменьшает образование азотсодержащих веществ и препятствует поглощению аммиака в толстой кишке.
Высокой специфичностью к патогенным и условно-патогенным микроорганизмам обладают бактериофаги. Избирательность их действия значительно выше, чем антибиотиков или химиотерапевтических средств. Бактериофаги являются узкоспецифичными антимикробными агентами, и они селективно лизируют только специфичные бактерии. Метод фаготерапии может успешно применяться не только при лечении, но и для профилактики ряда заболеваний, в том числе воспалительных заболеваний пародонта.
Бактериофаги лизируют антибиотико-устойчивые формы микроорганизмов. Стафилококковый бактериофаг, первоначально предназначавшийся для лечения и профилактики инфицированных ран, может быть достаточно эффективно использован при лечении дисбактериоза желудочно-кишечного тракта, связанного со стафилококковой инфекцией, при лечении и профилактике воспалительных заболеваний полости рта, а также рекомендуется при лечении абсцессов и остеомиелита челюстно-лицевой области. Применение бактериофагов на стадии проведения противовоспалительной и антибактериальной терапии воспалительных заболеваний пародонта может быть весьма перспективным.
Применение биологических препаратов в стоматологии О применении микробных биопрепаратов в стоматологической практике в отечественной и зарубежной литературе имеются лишь немногочисленные сообщения.
Так, Ходанова Р. Н., Демиховский И. Е. (1973) с положительным результатом использовали взвесь кисломолочных лактобацилл при лечении стоматита. Кашковская Н. В., Шутова А. П. (1988) сообщали об эффективности препарата из ацидофильных лактобацилл при назначении его больным гингивитом и стоматитом. Положительная микробиологическая и клиническая динамика наблюдалась у 90% больных, втом числе у 73% нормализовалось содержание лактобацилл, в 2 раза снизилась частота выделения энтерококка и золотистого стафилококка, ни у одного больного в результате лечения не обнаружили кишечную палочку и «-гемолитический стрептококк.
В последнее время бактерийные препараты стали достаточно активно применяться в комплексе мероприятий при лечении гнойных ран челюстно-лицевой области.
Так, на примере лактобактерипа была изучена эффективность биопрепаратов при местном их применении у больных с абсцессами и флегмонами челюстно-лицевой области (Кашковская Н. В.,1992). В случае легких и среднетяжелых форм заболеваний биопрепарат не уступал широко применяемому у таких больных антисептику хлоргек-сидину. Более того, по санирующей активности в отношении а- гемолитических стрептококков биопрепарат оказался более эффективным. При тяжелых формах заболевания лечение хлоргексидином способствовало более быстрому купированию процесса. По мнению Кашковской П. (1992), в этих случаях включение биопрепаратов в схему лечения является целесообразным на более поздних стадиях вслед за средствами противомикробной терапии, что будет способствовать восстановлению нормальной микрофлоры полости рта и получению стойкого клинического эффекта.
По данным Бибермана Я. (1989) и Дерябина Е. (1998), использование эубиотиков бифидумбактерина-форте и лактобактерина в клинике челюстно-лицевой хирургии способствует быстрому очищению гнойной раны, благоприятному течению послеоперационного периода, сокращает сроки лечения.
Агеева Л. (1999) с целью предупреждения развития воспалительной реакции использовала местное и энтеральное применение аци-лакта перед хирургическим вмешательством но устранению нёбной расщелины у детей первого года жизни. Предоперационная бактерио-терапия позволила получить хороший лечебный эффект у детей с неполной расщелиной верхней губы в 85%, с полной расщелиной – в 80%. У 11 из 15 оперированных детей отмечено гладкое течение послеоперационного периода и заживление раны первичным натяжением. Ни в одном случае не возник кандидозный стоматит на фоне антибактериальной терапии, частота которого до применения ацилакта составляла 30 %.
Ронь Г., Григорьев С. (1999) при лечении кандидоза слизистой оболочки рта воздействовали на микрофлору полости рта и факторы местного иммунитета с помощью перорального применения эубиотика биоспорина. После лечения отмечалась нормализация микробного пейзажа во всех биотопах слизистой оболочки рта. Григорьевым С. (2001) биоспорин применялся в комплексном лечении болезни Шег-рена. Биоспорин улучшает микробный пейзаж в полости рта посредством вытеснения патогенной микрофлоры бактериями В. subtitis, входящими в состав препарата. При использовании биоспорина увеличивалась активность лизоцима слюны, возрастало количество секреторного иммуноглобулина Л, а также повышалась скорость слюноотделения,
В комплексном лечении заболеваний слизистой оболочки рта необходимо проводить лечебные мероприятия по коррекции и нормализации нарушенного микробиоценоза. Опубликованы работы о применении бактериальной терапии для коррекции микрофлоры при различных заболеваниях слизистой оболочки рта (Банченко Г., Морозова Л., 1990; Шабанская М., 1991). В ходе проведенных исследований выяснилось, что различные формы глоссита и глоссалгии сопровождаются значительным снижением, а иногда и полным отсутствием лактобациллярного звена аутофлоры. При язвенно-некротическом стоматите в полости рта преобладала строго анаэробная флора (фузобактерии, спирохеты, бактероиды, актиномицеты), лактобациллы практически отсутствовали. У больных, страдающих красным плоским лишаем, часто вообще не удавалось выявить представителей физиологической микрофлоры. Авторы отмечают, что при дисбактериозе полости рта, который встречался в 100% случаев при данных заболеваниях, наибольшие изменения претерпевают представители рода лакто-бацилл. После первого курса лечения бактерийными препаратами у всех больных был отмечен клинический и бактериологический эффект, степень которого зависела от исходной тяжести патологического процесса и выраженности дисбактериоза.
Применение ацилакта у больных хроническим рецидивирующим афтозным стоматитом, наряду с нормализацией микрофлоры полости рта, привело к положительным сдвигам в составе бактериоценоза кишечника, с увеличением высева лакто- и бифидобактерий (Шабанская М., 1991).
При местном применении ацилакта в лечении генерализованного пародонтита легкой и средней степени тяжести была отмечена нормализация микробиологической картины полости рта (Мельничук Г., 1995). Скорость слюноотделения при пародонтите средней степени тяжести возросла с 3,02+0,22 до 3,76±0,24 мл/мин. Автор утверждает, что у пациентов с пародонтитом легкой степени под влиянием лечения глубина пародонтальных карманов за год уменьшилась с 2,76+0,05 до 2,15±0,02 мм. Лечение, пародонтита легкой и средней степени эубиотиком ацилакт приводило к нормализации состава микрофлоры пародонтальных карманов, к элиминации представителей условно-патогенных штаммов и восстановлению биоценоза полости рта. Результаты применения трихопола, по мнению автора, были значительно менее выражены по сравнению с применением ацилакта. Количество извитых форм микроорганизмов в пародонтальных карманах под влиянием лечения ацилактом снизилось при легкой степени пародонтита с 14,33+3,2 до 1,75+0,35 и при средней - с 39,35+6,52 до 2,15+0,37. Ремиссия заболевания под влиянием ацилакта отмечалась длительностью в 2 года.
Исследованиями Шабавской М. (1991), Мельничук Г. (1995) было установлено, что штаммы Lactobacillus acidophilus, выделенные от пациентов с заболеваниями пародонта и слизистой оболочки рта, обладают высокой чувствительностью к антибиотикам групп пенициллина, макролидов, цефализину, тетрациклину и клафорану при достаточно высокой степени резистентности к аминогликозидам, линкоми-цину и стрептомицину. Целесообразно учитывать полученные данные в случае сочетанного применения антибиотиков с микробными препаратами в целях максимального щажения лактобациллярного звена аутофлоры.
Ефимович 0. (2001) в схему комплексной терапии кандидомикоза полости рта в качестве заместительной терапии предлагает включить эубиотики, оказывающие антагонистическое действие в отношении патогенной и условно-патогенной микрофлоры и обеспечивающие ви-таминообразующую и ферментативную функции.
Для лечения детей с острым герпетическим гингивостоматитом McCord N. (1988) применил водную суспензию лактобацилл. Это позволило к 5-7-му сеансу лечения купировать клиническую симптоматику. Амбарцумян А. (1988) проводил лечение воспалительных заболеваний пародонта, используя штамм молочнокислых бактерий Epil 7/402. Тампоны, смоченные культурой молочнокислых бактерий, вводили в пародонтальные карманы. В результате лечения прекращалось гноетечение из карманов, уменьшались кровоточивость десен, ощущение зуда в деснах.
По мере прогрессирования воспалительного процесса в пародонте происходит существенное нарушение биоценоза полости рта за счет роста количества патогенных микроорганизмов и снижения концентрации аутофлоры. Это обусловливает необходимость не только активного подавляющего воздействия на патогенные виды микроорганизмов, но и восстановления концентрации постоянной микрофлоры с помощью её введения в виде бактерийных препаратов.
При пародонтите средней и тяжелой степеней непосредственное введение взвеси лактобактерина в пародонтальные карманы оказывает более выраженное коррекционное воздействие на клинические показатели и микрофлору пародонтальных карманов, чем использование таблетированной формы препарата.
Использование препарата лактобактерин, действующим началом которого являются штаммы Lactobacillus casei, в отличие от антисептических средств позволяет значительно улучшить не только состав микрофлоры полости рта, но и показатели местного иммунитета: повысить активность лизоцима и нормализовать уровень секреторного иммуноглобулина А.
Единичные сообщения о применении бактериальной терапии в стоматологической пракгике встречаются в зарубежной литературе. Это касается, в частности, французского препарата имудон (Solvai Pharma). Его назначают при лечении гингивита, пародонтита, перикоронарита, стоматита, тонзиллита. A. Daniel (1981) при лечении хронического катарального гингивита с использованием имудона отметил повышение местной иммунной защиты полости рта в результате стимуляции продукции SIg А. Установлено, что включение препарата в комплекс предоперационных мероприятий по хирургическому лечению пародонтита снижает риск развития осложнений, а также значительно продлевает срок ремиссии (Bauer E., Syrzitic I., 1984J.
Все вышеперечисленные данные подтверждают перспективность метода бактериальной терапии в системе профилактических и терапевтических мероприятий в стоматологической практике. Лечение воспалительных заболеваний тканей пародонта с включением в комплекс лечения бактериальных препаратов позволит корректировать состояние микробиоценоза и улучшить показатели местного иммунитета.
Контрольные вопросы:
1. Какую роль играет микрофлора полости рта в развитии стоматологических заболеваний?
2. Перечислите известные Вам группы биологических препаратов и охарактеризуйте их.
3. Назовите биопрепараты, показанные к применению в стоматологии.
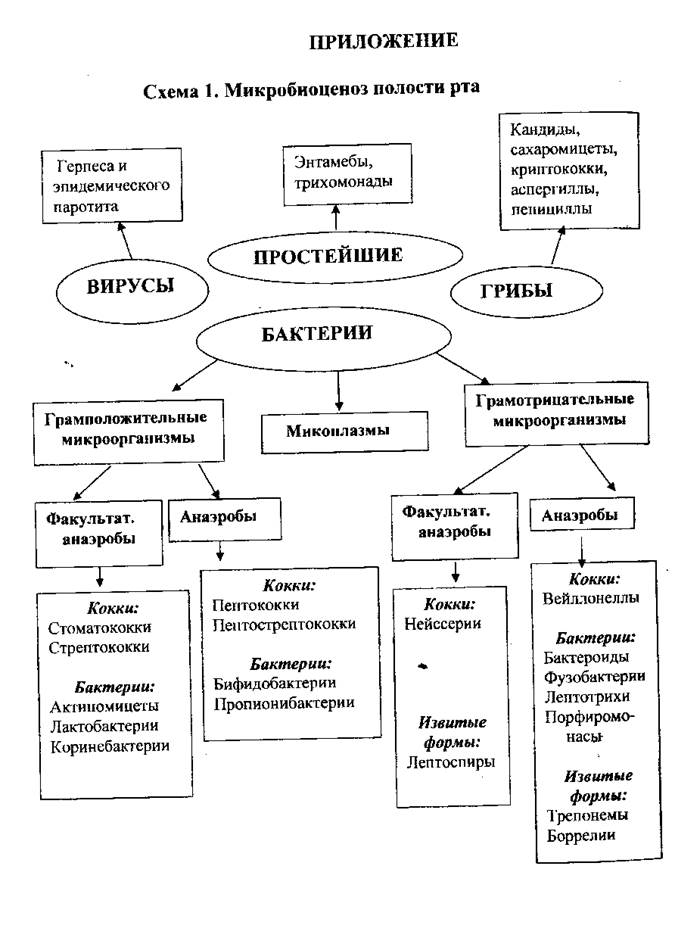
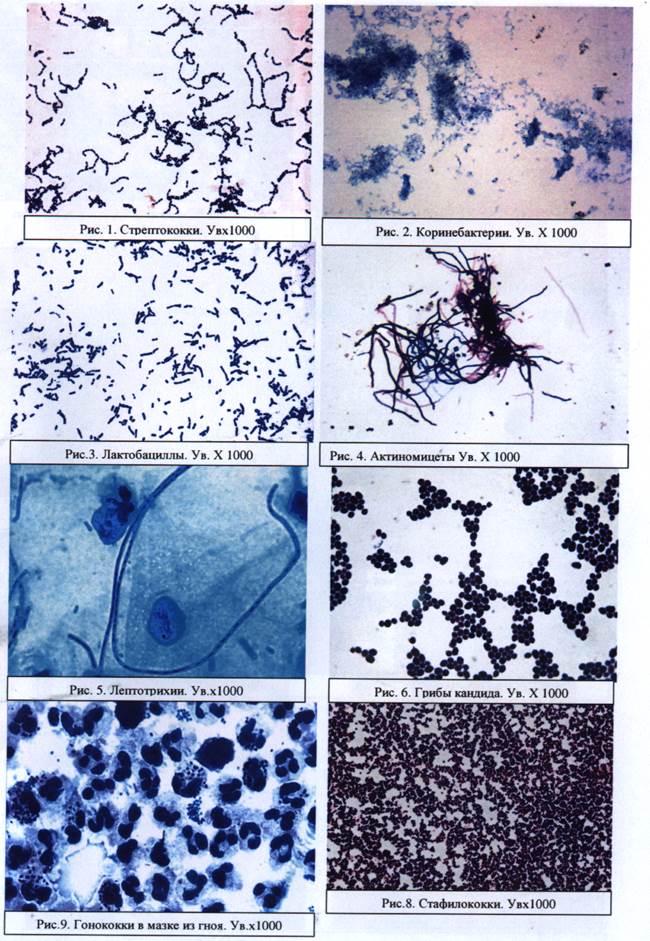


Таблица 3. Основные маркеры лимфоцитов
| Рецепторы | Определяемый тип клеток |
| CD3 | Зрелые Т-лимфоциты |
| CD4 | Т-хелперы/индукторы |
| CD8 | Т-супрессоры/цитотоксические |
| CD16 | NК-клетки |
| CD19 | Незрелые и зрелые В-лимфоциты |
| CD20 | Зрелые В-лимфоциты |
| CD25 | Активированные Т-клетки |
| CD95 | Fas-положительные клетки (реуептор, опосредующий аптоз) |
 2015-06-10
2015-06-10 2557
2557